Chimie și Tehnologie Chimică
Structura nivelelor electronice ale atomilor acestor elemente se caracterizează printr-o finalizare aproape completă a nivelului sublevel al penultimului nivel cu șase fier, șapte în cobalt și opt în nichel. Umplerea - sublevelul atomilor acestor elemente afectează scăderea numărului de oxidare. deoarece există mai puțini electroni nepartiți pe t-subsub (vezi Cursul de Chimie, Partea 1. General teoretic, Capitolul 11, p. 86). Prin urmare, dacă manganul este încă caracterizat printr-un număr de oxidare de +7. atunci atomul de fier nu poate da mai mult de 6 electroni și, prin urmare, numărul său de oxidare nu poate fi mai mare de +6. Numărul oxidativ de cobalt nu poate fi mai mare de +5 și nichel -1-4. În acest fel. La atomii acestor elemente este deja imposibil să se considere că toți electronii de nivele nefolosite sunt valențe. Simultan cu creșterea stabilității unui t-subsub aproape complet, tendința acestor elemente la compușii metalici cu conductivitate electronică scade. [C.126]

Fig. 20-23. Cytochromul c, care este o proteină globulară cu 104 aminoacizi legați la un lanț, și un grup heme. conținând un atom de fier. În această schemă schematică, fiecare aminoacid este reprezentat condițional de un număr de-
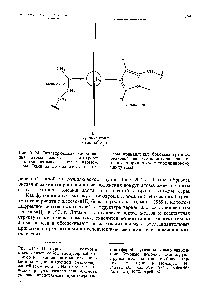
Structura nivelelor electronice ale atomilor de fier, cobalt și nichel se caracterizează printr-o finalizare aproape completă a subsolului penultimului nivel electronic, șase electroni - fier, șapte cobalt și opt - nichel. Umplerea - sublevelul atomilor acestor elemente afectează scăderea numărului de oxidare. deoarece există mai puțini electroni nepartiți în subsol. Prin urmare, dacă manganul este încă caracterizat printr-un grad de oxidare de 4-7, atunci atomul de fier nu poate da mai mult de șase electroni și, în consecință, starea sa de oxidare nu poate fi mai mare de 4-6. Numărul oxidativ al cobaltului nu poate fi mai mare de 4-5, și nichelul 4-4, Astfel. toti electronii nivelelor nealimentate nu pot fi considerati atomi de valenta ai atomilor acestor elemente. Simultan cu creșterea stabilității sub-nivelului aproape completat, tendința acestor elemente de a forma compuși metalici cu conductivitate electronică scade. Conductivitatea electrică de acest tip este posedată numai de silicele acestor metale. [C.297]
O hibridizare similară apare și în elementele de tranziție. În acest caz, sunt combinate 3d-, 4s- și 4 / -orbite. De interes deosebit este s / j d hibridizarea. Pauling a arătat că, deși există șase toroane electronice echivalente direcționate, de exemplu, de-a lungul direcțiilor pozitive și negative ale axelor x, y, z (hibridarea octaedrice). Aceste hibrizări au fost folosite pentru a explica structura compușilor complexi de tipul ionilor Fe (N) s sau Co (NH3) 6. atom de fier are electroni exterioare (3df (4s). Ion Fe + are structura (3d) „(4s) Este energetic favorabil trei excita un electron de la stat la starea W 4p. stare Apoi transportate (MU (4s) în ionul urmat ( 4p). Doi / electroni, unul 4S și trei 4p da octaedrice hibridizare. rezultând șase legături puternice. compensarea energiei cheltuite excitare ua. [c.480]
Uneori modificări mici în mediul înconjurător pot provoca schimbări serioase în forma proteinei. care îi vor afecta funcțiile. De exemplu, o ușoară creștere a pH-ului sanguin modifică molecula de hemoglobină astfel încât să devină capabilă să treacă pe suprafața interioară a plămânilor și un atom de fier se deschide în moleculă. ca rezultat, oxigenul este ușor asociat. Atunci când pH-ul este scăzut, lanțul din nou se îndoaie, ajutând la izolarea oxigenului după ce a fost transferat în celula unde este necesar. [C.455]
În contact cu electrolitul, atomii de metal localizați pe suprafața structurii (conductă) sunt expuși câmpului de forță al moleculelor de apă. care pot fi încorporate în rețeaua de cristal a structurii metalice. Impactul forței poate fi atât de puternic încât legătura dintre atomii de metal și grâul de cristal este întreruptă. Atomii metalici ai structurii dislocați astfel intră în electrolit, formând un atom de ion care poartă sarcina. Moleculele de apă, care sunt dipoli, sunt orientate în jurul atomului de ioni. Atomul de fier trece în electrolit, având o încărcătură pozitivă. iar structura este încărcată negativ. Deci, există un strat dublu electric. în care ionii de fier hidratați sunt ținute la suprafața structurii prin forțele electrice de interacțiune cu încărcăturile negative ale structurii. Poate veni un moment în care, sub influența forțelor electrice, se ajunge la un echilibru în stratul electric dublu, iar tranziția ulterioară a atomilor de oțel în electrolit încetează. [C.6]
Câte grame de aluminiu sunt recuperate din oxidul de fier a) 5,6 g de fier b) atom de fier de 4 g [p.102]
Predicția valenței. Dacă pornim de la ipoteza că valența unui atom este egală cu numărul de electroni nepartiți ai cochiliei sale exterioare. atunci atomii de gaze nobile nu trebuie să dea nici un fel de compuși cu alți atomi, deoarece în starea de bază se rotesc rotirile tuturor electronilor. Între timp, s-au descoperit și cercetat compuși ai gazelor nobile cu halogeni și oxigen, ca în cazul lui Her. HeO 4, Xe 2, etc. Este chiar mai dificil să se explice existența așa-numitelor compuși de tip sandwich. de exemplu ferocen, unde atomul de fier este legat de două molecule ciclice de CdH. (Figura 17). El ar trebui să formeze legături cu zece atomi de carbon fără a avea zece electroni în cochilia de electroni exteriori. [C.57]
Care este raportul (în procente) de crom și fier în ferocrom, în care pentru fiecare trei atomi de crom există un atom de fier [c.162]
Conform ecuațiilor (1) și (2), 1 g atom de fier reacționează cu 1,5 mol de clor și 1 g de cupru cu 1 mol de clor. În acest caz, cantitatea de clor. reacționat cu Fe și Cu, poate fi exprimat prin următoarea ecuație [c.450]
Calcularea masei atomului de fier în grame. 1 atom de grupe de fier are o greutate totală de 55,85, numărul de atomi din acest număr este de 6-10. Masa unui atom de fier = 55,85 g 6-10 = 9,3 g. Probleme similare pot fi rezolvate în felul următor: [c.7]
Hidrogenarea monoxidului de carbon pentru a forma alcooli și hidrocarburi peste Gj este o reacție catalitică relativ lentă. Anderson [27c] a calculat că molecula de monoxid de carbon trăiește pe suprafața catalizatorului de cobalt timp de aproximativ 5 minute. înainte de a reacționa. Toți catalizatorii activi de sinteză conțin fier, nichel, cobalt sau ruteniu ca principală componentă de hidrogenare. Aceste patru metale, în condiții de sinteză lentă, dar la o rată măsurabilă, formează carboniluri de metale, care, aparent, au o valoare definită. Temperatura optimă de sinteză pentru nichel și cobalt este în intervalul 170-205 °, pentru fier 200-325 ° și pentru ruteniu 160-225 °. Presiunea maximă admisă pentru sinteza pe catalizatorii de nichel este de aproximativ 1 atm, pe cobalt - aproximativ 20 at. La o presiune mai mare, activitatea acestor catalizatori scade brusc (pe măsură ce crește presiunea). Catalizatori de fier. preparate prin topirea magnetitului, prezintă activitate la o presiune de 20-100 ° C la i, în timp ce catalizatorii de fier precipitați peste 20 atm slăbesc I27d]. Catalizatorii de ruteniu sunt relativ inactivi la presiuni sub 100 atm, dar activitatea lor creste rapid crescand la 300 at. La presiuni optime (0-1 la pentru Ni 1-20 at pentru Go, 1-20 la pentru catalizatori de Fe precipitat, 20-100 la catalizatori de Fe pentru topitura si 100-300 la pentru Lu), coeficientul de presiune (exponentul n in viteza ecuației = co-isat x x presiune ") este de aproximativ 0-0,5 pentru Ni și Go și este aproape de unitate pentru Fe și Ru [c.521]
Oxizi și giroxizi. Fierul formează cu oxigen următorii oxizi simpli ai FeO, FeOO și FeO3. Oxidul de FeO are un caracter de bază. Pegos-amfoteric, FeO3-acid. Primele două oxizi se pot combina pentru a forma Oxidul Pc3O4 de sourcane, în care unul dintre atomii de fier este în stare de oxidare + 2, iar ceilalți doi sunt oxidați la -S3. [C.302]
În schimb, a fost izolat un produs de reacție portocaliu. în moleculă a cărui atom de fier sa dovedit a fi inclus. În paralel cu SUA, un grup de chimiști a primit exact același compus. Ei au decis că această substanță este bis-ciclopentadienil fier. [C.218]

Complexarea fierului cu bioligandi are o mare importanță [2, p. 165-184]. Este deosebit de important hemoglobina, o moleculă de proteine care conține fier. îndeplinind funcțiile unui purtător de oxigen în sângele animalelor și al oamenilor. Hemoglobina conține un globin de proteine și patru heme. reprezentând un complex porfirinic de fier (II), în care atomul de fier formează o legătură cu cei patru atomi de azot ai ciclului porfirinic, și o legătură la un atom de azot amino gistidina- acidă, o parte din b1elka globinei. Locul al șaselea în sfera de coordonare a fierului (II) pot fi ocupate cu oxigen molecular O2 și liganzi de tip CO, CN și colab. Dacă hemoglobina introdusă au reacționat, de exemplu, cu CO, isi pierde capacitatea sa de a atașa O2 reversibil. În acest caz, corpul moare de hipoxie. Acest lucru explică toxicitatea ridicată a liganzilor CO, SC și a liganzilor asemănători. [C.134]
Cât de multe fier de oxid de oxid de fier P4 formează un atom de 6 g de fier în combustia lor completă în aer Răspunde exprimat în mol și grame. [C.107]
VII.4, unde punctele 2 și 3, de exemplu, corespund stărilor de oxidare ale Fe (II) și Fe (III). In complexul Na2 [Fe (N) 5NO], prezentată la punctul Fig.4, în funcție de taxa atribuită nitrozo N0 pozitiv, zero, un atom de fier negativ (neutru grup) sau ar putea avea un grad de oxidare (II), (III ) sau (IV). Bazat pe o deplasare chimică e2rz / 2 (711.0 eV la 710.0 eV, spre deosebire de Ks [e Fe (CN)] și 708.7 la K4 [Fe (CN) b]), gradul de oxidare a fierului din complex este ( IV). Aceasta indică faptul că încărcarea grupului nitrozo este negativă. [C.159]
Notați multiplicatorul 2, care apare în al doilea rând. Conform formulei FeSj, există 2 atomi de sulf per atom de fier, prin urmare sistemul nostru va fi rescris ca Fe 2 -e- = Fe 1 [c.97]
O clasă largă de complecși sunt complecși Vitchev cu nisip, care este un strămoș al ferocen, Ferocen este cristale galben-portocalii ale compusului organometalic în care este localizat atomul de fier între două inele foarte simetrice cu cinci membri. formată de atomi de carbon (vezi schema 13.7). [C.369]
Conexiunea în ferocen poate fi luată în considerare din punctul de vedere al unei teorii simplificate a orbitalilor moleculari [80]. Fiecare inel ciclopenta-dienil are cinci orbite moleculare, trei orbitale obligatorii umplut și două orbite dezintegrabile vacante (Secțiunea 2.9). Învelișul de electroni exterior al atomului de fier este compus din nouă orbitali atomici unul 45, trei și cinci 4R- Sc (d Orbitali. Șase orbitalii ocupate ale celor două inele ciclopentadienil se suprapun unul cu z-, trei și doi orbitali p ale atomului de fier, dând douăsprezece noi orbitali , dintre care șase sunt obligatorii și metal formează două legături triple inel. legare suplimentară este rezultatul suprapunerii vacante orbitali antibonding inele cu celelalte orbitalii de fier populate. de aceea. pentru nouă orbitali Rep 18 este localizat electroni (care poate fi privit ca 10 electroni dau două inele, și 8 -. Atom de fier în starea de oxidare zero) șase orbital - puternic caracter obligatoriu și trei. - slabă legare sau nonbinding [c.72]
A. Se obține sarea Mohr (NH4) 2504-Fe304-6H20. Se calculează cantitatea de acid sulfuric 25%. necesar pentru a dizolva 0,5 g de fier și pentru a lua un exces de 1,5 ori. Se toarnă pulberea de fier într-un tub de testare, se adaugă acid sulfuric și se încălzește ușor. Când metalul se dizolvă. soluția este filtrată și evaporată într-o placă de porțelan până când crusta cristalină se formează pe suprafață. Se prepară o soluție fierbinte, saturată de sulfat de amoniu, pentru a avea o moleculă de sulfat de amoniu pe atom de fier. Soluțiile rezultate sunt amestecate cu fierbinte și lăsate să cristalizeze la 0 ° C. Se separă cristalele de lichid și se usucă cu hârtie de filtru. Se cântărește sarea și se calculează randamentul ca procent din fier. [C.398]
Precipitatul a fost indepartat prin filtrare, se spală cu apă rece și se usucă la 40-50 ° C Geksabeizo-atom de fier (III) de culoare -substanță silex, stabil în aer, insolubil în apă, solubil în acetonă, din care poate perekristallnzovat [c.264 ]
Structura ferocen, primul metalocenul sintetizat în 1951 Georgia (Kim și Pawson) a sandvicheobraznoe - între doi atomi de inel ciclopentadienilic paralel este de fier, iar molecula are un centru de simetrie (XVI). Ulterior, alte metaloceni de tip XVI, în care au fost obținute atomul de fier a fost înlocuit cu atomi de Ti, V, Cr, Mn, Co, N1, Ri, Oz, Mg. [C.307]
Când numărul atomilor de fier este mai mare decât unul. se formează un cluster (roi), în care, după cum se presupune, există o legătură unică între atomii de fier. Clusterul conține, în plus față de cis-steină, sulful labil și poate accepta să dea un electron. O proteină tip 1Pe-5, adică conținând un atom de fier, și anume rubredoxina, a fost atent studiat într-o varietate de moduri. Ca rezultat, sa demonstrat că singurul atom de fier din molecula de proteină este înconjurat de patru reziduuri de cisteină situate la vârfurile tetraedrului. Atât starea (oxidată și redusă) a complexului este spinul înalt. Aceste proteine au o greutate moleculară de aproximativ 6000 și pot transmite un electron pe moleculă. [C.366]
Vedeți paginile în care se menționează termenul Iron Atom. [C.219] [c.121] [c.192] [c.367] [c.219] [C.16] [C.15] [c.150] Lucrări de popularizare a științei, istoric, critic și bibliografic și alte lucrări pe chimie Volumul 3 (1958) - [c.229]
Articole similare
-
Celula galvanică pentru măsurarea elementului ph - cartea de referință a chimistului 21
-
Distilarea și rectificarea alcoolului etilic - ghidul chimistului 21
Trimiteți-le prietenilor: