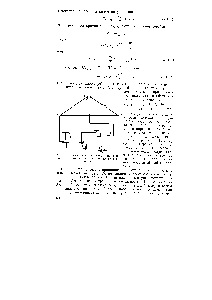
Fig. 29. Diagrama electrică a instalației pentru măsurarea emf. etc cu. celulele galvanice
Potențialele standard oferă o idee despre posibila direcție a reacțiilor chimice de oxidare-reducere. Cu toate acestea, în condiții reale, această direcție poate fi diferită din următoarele motive. Sisteme de reducere a oxidării. în funcție de rata de reacție. care curg pe electrozi, sunt împărțite în reversibile și ireversibile. Potențialele standard ale sistemelor reversibile sunt măsurate direct prin metoda descrisă mai sus, în timp ce potențialele standard ale sistemelor ireversibile sunt găsite în majoritatea cazurilor prin calcule termodinamice. În consecință, în practică, valorile lor se dovedesc a fi diferite, deoarece ele sunt influențate de mulți factori. De exemplu, pentru sistemele ireversibile, nu există o schimbare regulată a potențialului în funcție de schimbarea concentrației componentelor sistemului. și calcule efectuate utilizând potențialele de oxidare standard și concentrațiile componentelor. sunt mai ilustrative decât corespund datelor actuale. Prin urmare, potențialele formale (reale) ale sistemelor de reducere a oxidării au o importanță practică mult mai mare. Potențialele formale (φ) se găsesc prin măsurarea emf. etc cu. celulă galvanică. în care concentrațiile inițiale ale componentelor oxidului [c.350]
Expresia (V.5) permite utilizarea e. etc cu. element galvanic pentru studiile termodinamice ale proceselor. care curge pe electrozi. Complexitatea acestor studii este acela că pentru conectarea directă la o celulă electrochimică a mijlocului de măsurare convențional (voltmetru) echilibrul termodinamic în sistem este rupt. Aceasta, așa cum sa arătat mai devreme, duce la o distorsionare a rezultatelor, deoarece nu este măsurată prin e. etc cu. elementul E și diferența dintre potențialele electrostatice ale electrozilor și ale lor. În timpul măsurătorilor, se observă că toate regulile funcționează cu instrumentul de măsurare utilizat. Măsurați temperatura soluțiilor. [C.165]
Sursa DC (vezi Figura 28) ar trebui să fie pornită de către comutatorul P, iar apoi tasta K pornește elementul normal sau celula. e. etc cu. care este măsurată. Opriți în ordine inversă. Dacă măsurarea e. etc cu. nu există nici o compensație pentru nici un potențiometru, este necesar să se verifice corectitudinea ansamblului dispozitivului de măsurare în conformitate cu schema (vezi figura 28) a polilor elementului de testare și a sursei de curent. precum și contactele. Oscilațiile măsurătorilor paralele indică un contact slab în circuitul principal (circuitul sursei de curent). Dacă nu există curent în circuitul lateral, verificați toate contactele și starea conductorilor. Este imposibil să aveți bule de aer în secțiunile de sticlă pentru contact și în puntea electrolitică. Terminalele de pe plăcile metalice ale electrozilor nu trebuie să atingă soluțiile. Este necesară verificarea sistematică a tensiunii sursei de curent și calibrarea potențiometrului. Conectați celula de testare și elementul normal cu tasta la potențiometru numai pentru timpul de măsurare al emițătorului. etc cu. și la intervale foarte scurte pentru a exclude fenomenele de polarizare și schimbarea concentrației de ioni în soluții datorită funcționării elementului. Pentru a reduce difuzia ionilor de la o jumătate de celulă la alta, ele sunt conectate printr-o punte electrolitică, numai înainte de a măsura emf-ul. etc cu. Podurile sunt depozitate într-o soluție sare saturată. Electrozii și celulele galvanice sunt colectate în recipiente de sticlă. ale căror forme sunt descrise în lucrări. [C.142]
Elementele galvanice de acest tip se numesc elemente con-centrale. Practic, aceste elemente nu sunt folosite pentru obținerea curentului. dar din punct de vedere al teoriei și al metodologiei de măsurare, ele prezintă un interes. De exemplu, pe baza e. etc., a unui astfel de element, putem determina concentrația de ioni necunoscute pentru noi. [C.165]
În Fig. 129 prezintă schema irinzipială a măsurării emf. etc cu. celulă galvanică. Circuitul compensator include NZ sursa de curent - bateria 1, tensiunea care este furnizată slidewire AB, elementul 2 galvanometru sensibil 10 și elementul de testare Weston nerek nochatelya 4 5 6 Intrerupator și C. contact mobil Metoda se bazează pas care măsoară e. etc cu. este echilibrat (compensat). etc cu. baterie. [C.298]
Vedeți paginile în care este menționat termenul "celulă galvanică pentru măsurarea pH-ului". [C.268] [c.424] [c.195] [c.126] [c.138] [c.309] [c.304] Determinarea pH-ului Teorie și practică (1968) - [C.0]
Articole similare
Trimiteți-le prietenilor: