1. Conceptul de reacții chimice
2. Clasificarea reacțiilor chimice prin diferite caracteristici
Lista literaturii utilizate
Substanțele, care interacționează unele cu altele, suferă diverse schimbări și transformări. De exemplu, beriliul care interacționează cu oxigenul de aer la o temperatură de peste 500 ° C se transformă în oxid de beriliu; cărbune, ardere, formează dioxid de carbon și altele asemenea.
Fenomenele în care unele substanțe sunt transformate în altele diferite de compoziția inițială și proprietăți, și astfel nu se schimbă compoziția nucleelor atomice, numite chimice.
Oxidarea în aer, arderea, obținerea de metale din minereuri, ruginirea fierului - toate acestea sunt fenomene chimice. În caz contrar, ele se numesc transformări chimice, reacții chimice sau interacțiuni chimice.
Scopul acestei lucrări este de a studia caracteristicile reacțiilor chimice și clasificarea acestora.
Lucrarea constă într-o introducere, două capitole, o concluzie și o bibliografie. Valoarea totală a lucrărilor este de 17 pagini.
1. Conceptul de reacții chimice
Proprietățile chimice ale substanțelor sunt descoperite într-o varietate de reacții chimice. Transformări ale substanțelor, însoțite de o schimbare a compoziției și structurii lor și se numesc reacții chimice.
Deseori găsită și o astfel de definiție: reacția chimică este procesul de transformare a substanțelor inițiale (reactivi) în substanțe finale (produse).
Reactivii sunt substanțe care reacționează chimic.
Produse - substanțe care se formează ca urmare a unei reacții chimice.
Reactivi → Produse
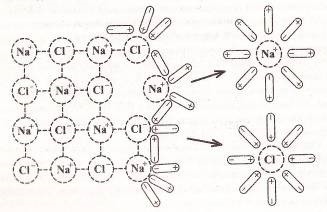
Tradus din latină, "reacție" înseamnă "opoziție, respingere, acțiune de represalii". În consecință, termenul reacție chimică poate fi înțeleasă ca răspunsul unei substanțe la influențele externe ale altor substanțe și factorii fizici - căldură, presiune, radiație. Dar, sub această definiție, se încadrează și procesele fizice: topirea, fierberea, înghețarea și altele. Prin urmare, trebuie clarificat faptul că reacția chimică - este variația speciilor în care frântă vechi și formarea de noi legături chimice între particule (atomi, ioni) din care sunt construite din materie.
„Forța de antrenare“ reacție depinde nu numai de natura reactivilor și compușii rezultați (compoziția lor, structură), dar și asupra concentrației substanțelor, temperatura, presiunea, efect de solvent, compuși capabili să formeze complecși cu reactanți și produse.
Reacțiile chimice sunt întotdeauna însoțite de efecte fizice - absorbția sau eliberarea căldurii, modificările în stare agregată și culoarea substanțelor; prin prezența acestor efecte sunt adesea judecați cursul reacțiilor (figura 1).
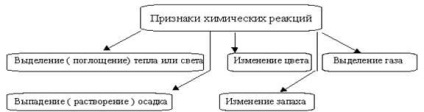
Figura 1 - Semne ale reacțiilor chimice
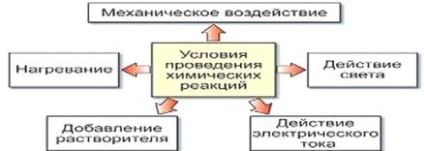
Reacțiile chimice trebuie diferențiate de procesele fizice care modifică numai forma externă sau starea agregată a substanței (dar nu și compoziția acesteia). Condițiile care trebuie îndeplinite pentru a produce o reacție chimică:
1. Este necesar ca substanțele de reacție să intre în contact și cu cât suprafața lor de contact este mai mare, cu atât mai repede va avea loc reacția chimică.
2. Unele reacții au loc fără încălzire, pentru unele reacții este necesar.
3. Unele reacții apar sub influența curentului electric și a luminii
Reacțiile chimice sunt înregistrate prin intermediul unor ecuații chimice. conținând formule de materii prime și produse de reacție, de exemplu:
A + B = AB De mai multe substanțe simple sau complexe, un complex
AB = A + B Mai multe substanțe simple sau complexe sunt formate dintr-o substanță complexă
A + BC = AC + B Un atom de substanță simplu înlocuiește unul dintre atomii unui complex
AB + CD = AD + CB Substanțele complexe își schimbă părțile componente
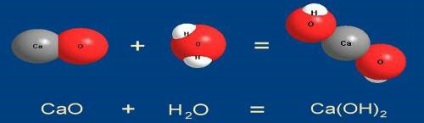
1. Reacția compusului. DI Mendeleyev a definit compusul ca o reacție "în care apare una dintre cele două substanțe. Astfel, atunci când reacțiile unui compus al mai multor substanțe reactive în raport cu o compoziție simplă rezultă într-o substanță cu o compoziție mai complexă
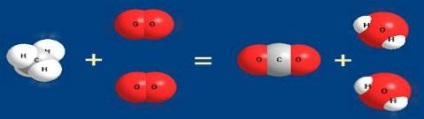
Reacțiile compusului includ arderea substanțelor simple (sulf, fosfor, carbon) în aer. De exemplu, carbonul arde în aer C + O2 = CO2 (desigur această reacție se desfășoară treptat, se formează primul monoxid de carbon CO). De regulă, aceste reacții sunt însoțite de eliberarea căldurii, i. E. conduc la formarea unor compuși mai stabili și mai puțin bogați în energie - sunt exotermați.
Reacțiile compusului de substanțe simple sunt întotdeauna oxidare-reducere. Reacțiile unui compus care curge între substanțe complexe pot să apară atât fără o schimbare a valenței
CaCO3 + CO2 + H2O = Ca (HCO3) 2
și se referă la numărul de redox
2FeCl2 + Cl2 = 2FeCI3.
2. Reacții de descompunere. Reacțiile chimice de descompunere, în conformitate cu Mendeleev, „cazuri, conexiunea inversă, adică acelea în care o singură substanță furnizează două sau, în general, un anumit număr de substante - mai multe dintre ele.
Reacțiile de descompunere duc la formarea mai multor compuși dintr-o substanță complexă
Produsele de descompunere ale unei substanțe complexe pot fi substanțe simple sau complexe. Un exemplu al reacției de descompunere poate servi ca o reacție de descompunere chimică cretă (calcar sau sub temperatura): CaCO3 = CaO + CO2. Ca regulă, încălzirea este necesară pentru a efectua reacția de descompunere. Astfel de procese sunt endoterme, adică curge cu absorbția de căldură. Din reacțiile de descompunere care au loc fără o schimbare stări de valență, trebuie remarcat faptul de descompunere cristaline, baze, acizi și săruri acide ale oxygenated
CuSO4 5H2O = CuS04 + 5H20,
Cu (OH) 2 = CuO + H20,
H2Si03 = Si02 + H20.
La reacțiile de descompunere a caracterului de oxidare-reducere se află descompunerea oxizilor, acizilor și sărurilor formate de elemente în stări de oxidare superioare
4HNO3 = 2H20 + 4N02O + O20,
2AgNO3 = 2Ag + 2NO2 + 02,
(NH4) 2Cr2O7 = Cr2O3 + N2 + 4H20.
Sunt deosebit de caracteristice reacțiile redox de descompunere pentru sărurile de acid azotic.
Reacțiile de descompunere din chimia organică, spre deosebire de reacțiile de descompunere din chimia anorganică, au propriile lor specificități. Acestea pot fi considerate procese de legătură inversă, rezultând adesea formarea unor legături sau cicluri multiple.
Reacțiile de descompunere din chimia organică se numesc fisuri
C18H38 = C9H18 + C9H20
sau dehidrogenarea C4H10 = C4H6 + 2H2.
În reacțiile celorlalte două tipuri, numărul de reactivi este egal cu numărul de produse.
3. Reacții de substituție. Trăsătura lor distinctivă este interacțiunea unei substanțe simple cu una complexă. Astfel de reacții există în chimia organică. Cu toate acestea, termenul de „substituție“ în materie organică este mai largă decât în chimia anorganică. Dacă molecula substanței de pornire a oricărui atom sau grupare funcțională sunt înlocuiți cu un alt atom sau grup, această reacție de substituție, de asemenea, cu toate că din punct de vedere al procesului chimiei anorganice arată ca reacția de schimb.
În reacțiile de substituție, de obicei o substanță simplă interacționează cu complexul, formând o altă substanță simplă și un alt complex A + BC = AB + C
De exemplu, scăderea cuiul de oțel în soluție de sulfat de cupru se obține sulfat de fier (cupru fier dislocat din sarea sa) Fe + CuSO4 = FeSO4 + Cu.
Aceste reacții în majoritatea covârșitoare aparțin redoxului
2Al + Fe2O3 = 2Fe + A1203,
Zn + 2 HCI = ZnCl2 + H2,
2KBr + Cl2 = 2KSl + Br2,
2KSO3 + 12 = 2Kl03 + Cl2.
Exemple de reacții de substituție care nu sunt însoțite de o schimbare a stărilor de valență a atomilor sunt extrem de puține.
Trebuie notat reacția dioxidului de siliciu cu sărurile acizilor care conțin oxigen, care corespund anhidridelor gazoase sau volatile
CaCO3 + Si02 = CaSi03 + CO2,
Ca3 (PO4) 2 + 3Si02 = 3CaSi03 + P2O5.
Uneori, aceste reacții sunt considerate ca reacții de schimb
CH4 + Cl2 = CH3CI + HCI.
4. Reacția schimbului (inclusiv neutralizarea). Schimbările de reacții se numesc reacții între doi compuși care schimbă între ei componentele lor constitutive
Un număr mare dintre acestea apar în soluții apoase. Un exemplu de reacție de schimb chimic este neutralizarea acidului cu alcaline
Aici reactivii (substanțe lăsate în picioare), un ion de hidrogen dintr-un compus HCI schimbat cu ioni de sodiu din compusul NaOH, rezultând o soluție de sare în apă.
Dacă reacțiile de oxidare-reducere apar în timpul reacțiilor de substituție, reacțiile de schimb se produc întotdeauna fără a schimba starea de valență a atomilor. Acesta este cel mai frecvent grup de reacții între substanțe complexe - oxizi, baze, acizi și săruri
ZnO + H2SO4 = ZnS04 + H20,
AgNO3 + KBr = AgBr + KN03,
CrCI3 + 3NaOH = Cr (OH) 3 + 3NaCI.
Un caz special al acestor reacții de schimb este reacția de neutralizare
HCI + KOH = KCI + H20.
De obicei, aceste reacții sunt supuse legilor echilibrului chimic și fluxul în acea direcție, în cazul în care cel puțin una dintre substanțele îndepărtate din zona de reacție ca materie gazoasă, volatile sau precipita malodissotsiiruyuschego (soluții) compuse
NaHC03 + HCI = NaCI + H20 + CO2 ↑,
Ca (HCO3) 2 + Ca (OH) 2 = 2CaC03 + 2H2O,
CH3COOHa + H3P04 = CH3COOH + NaH2P04.
Cu toate acestea, multe reacții nu se încadrează în schema simplă dată. De exemplu, reacția chimică dintre permanganatul de potasiu (mangan) și iodura de sodiu nu poate fi atribuită niciunuia dintre aceste tipuri. Astfel de reacții sunt denumite în mod obișnuit ca exemplu redox 2KMnO4 + 10NaI + 8H2 SO4 = 2MnSO4 + K2 SO4 + 5Na2 SO4 + 5I2 + 8H2 O.
Oxidarea-reducere în chimia anorganică include toate reacțiile de substituție și acele reacții de descompunere și compușii în care participă cel puțin o substanță simplă. Într-o versiune mai generalizată (luând în considerare și chimia organică) toate reacțiile care implică substanțe simple. Dimpotrivă, reacțiile care se desfășoară fără a schimba starea de oxidare a elementelor care formează reactanții și produsele de reacție includ toate reacțiile de schimb.
2. Clasificarea reacțiilor prin caracteristici de fază
În funcție de starea agregată a substanțelor care reacționează, se disting următoarele reacții:
1. Reacții la gaz:
2. Reacții în soluții:
NaOH (p-p) + HCI (p-p) = NaCI (p-p) + H20 (g).
3. Reacțiile dintre substanțele solide:
CaO (TV) + Si02 (TV) = CaSi03 (TV).
3. Clasificarea reacțiilor prin numărul de faze
O fază este înțeleasă ca un set de părți omogene ale unui sistem cu aceleași proprietăți fizice și chimice și separate între ele prin interfață.
Toate varietățile de reacții din acest punct de vedere pot fi împărțite în două clase.
1. Reacții omogene (monofazate). Acestea includ reacțiile care apar în faza gazoasă și un număr de reacții care au loc în soluții.
2. Reacții heterogene (multifazice). Acestea includ reacții în care reactanții și produsele de reacție sunt în diferite faze. De exemplu:
CO2 (g) + NaOH (p-p) = NaHC03 (p-p),
CO2 (r) + CaO (TV) = CaC03 (TV),
Na2SO4 (aq) + VaSl3 (p-p) = VaSO4 (TV) ↓ + 2NaSl (p-p),
Ca (HCO3) 2 (aq) + H2SO4 (aq) = CO 2 (g) ↑ + H2O (g) + SaSO4 (TV) ↓.
4. Clasificarea reacțiilor prin tipul de particule transportabile
Mai mult: Reacții protolitice
Informații despre lucrarea "Conceptul de reacții chimice și clasificarea acestora"
Sectiunea: Chimie
Numărul de caractere cu spații: 20245
Numărul de tabele: 2
Număr de imagini: 2
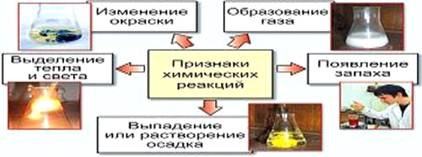
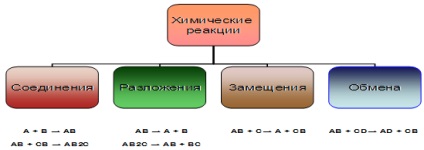
- reacția merge fără a schimba gradul de oxidare: S + 4O4-2 + H2O → H2 + S + 4O4-2 CH3NH2 + HCI → (CH3NH3) Cl După cum se observă, există diferite modalități de clasificare a reacțiilor chimice, dintre care le considerăm mai în detaliu după cum urmează. Pe baza modificării numărului de substanțe inițiale și finale. Aici găsiți 4 tipuri de reacții chimice (figura 6): reacția compusului, reacția de descompunere.
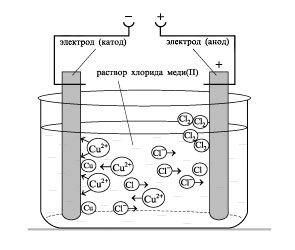
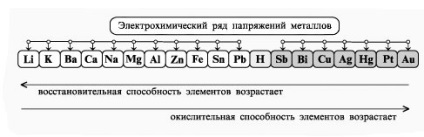
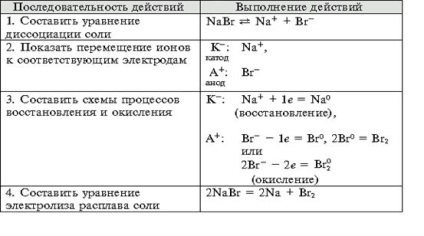
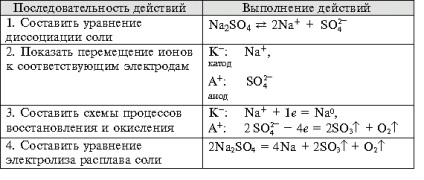
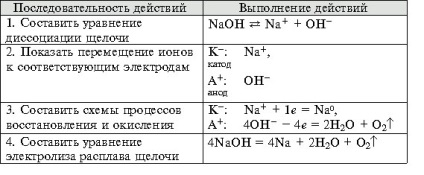
- Formarea competențelor tehnologice experimentului, capacitatea de a rezolva obiectivele de proiectare și de calitate, pentru a face ecuația reacțiilor chimice care au loc în electroliza soluțiilor și se topește organizarea elektrolitov.- independenței Educație, formarea capacității de a lucra într-un grup, dezvoltarea abilităților creative, gândire logică, atenție și de memorie. Echipamente: calculatoare.
Reacția mediului în acest caz depinde de raportul dintre constantele de disociere ale bazei și acidului corespunzător. Consolidați hidroliza prin diluarea soluției, încălzirea sistemului. 2. Reacții chimice Reacțiile chimice (fenomenele chimice) sunt procese, prin urmare unele substanțe se transformă în altele. Semnele reacțiilor chimice sunt: - schimbarea culorii;
Articole similare
Trimiteți-le prietenilor: