În cazul controlului anodic, viteza de coroziune scade odată cu creșterea concentrației de ioni metalici în apropierea suprafeței. Aceasta poate conduce la formarea de săruri slab solubile, care, prin ecranarea suprafeței metalului, cauzează dificultăți de difuzie în timpul reacției anodice.
Inhibarea reacției anodice este posibilă ca rezultat al pasivării metalului la contactul cu un oxidant puternic. Starea pasivă a metalului se caracterizează prin semne:
· Deplasarea potențialului metalic în direcția pozitivă;
· Rata coroziunii este semnificativ redusă și constantă în timp.
Apariție stare pasivă depinde de natura metalului, proprietățile sale, tipul de mediu coroziv (oxidant concentrație agent, conținutul de oxigen dizolvat), temperatura, viteza de recirculare a electrolitului. Încălcarea stării pasive este numită depășire.
Lupta superpassivation posibil prin deplasarea potențialului metalului în direcția negativă, scăderea concentrației de oxidant, adăugarea unui agent de reducere, sau prin polarizarea catodică a metalului sursă de curent externă.
Influența diferiților factori asupra vitezei coroziunii electrochimice.
Influența temperaturii.
Creșterea temperaturii facilitează difuzarea substanțelor care participă la procesele electrodului. Temperatura afectează concentrația în medii corozive a substanțelor care participă la procesele de electrozi. Coroziune în medii neutre cu depolarizare de oxigen scade odată cu creșterea temperaturii datorită deaeration oxigenului dizolvat. Schimbarea temperaturii poate reduce proprietățile de barieră ale filmelor de produse secundare (oxizi, hidroxizi, săruri cu solubilitate redusă), precum și de schimbare acoperiri metalice de tip polaritate: strat de zinc pe oțel carbon se comportă ca anod, și în apă fierbinte - ca un catod. Creșterea temperaturii poate duce la intensificarea și la încetinirea procesului de coroziune.
Efectul pH-ului mediului.
Cu privire la influența pH-ului mediului, metalele sunt împărțite în grupe:
1. Metale cu rezistență ridicată la coroziune în soluții acide, alcaline și neutre (cum ar fi Au, Pt, Ag). Viteza lor de coroziune nu depinde de pH-ul mediului (Fig.1a).
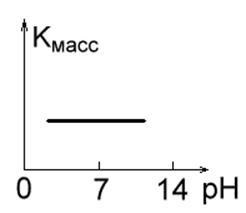
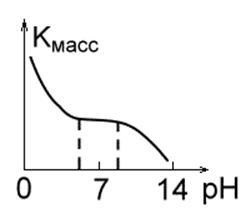
Fig. 1 a. Fig. 1 b.
2. Metalele care sunt stabile în mediu acid, cum ar fi Fe, Mg, Cu, Mn. La valori scăzute ale pH-ului, viteza de distrugere a acestora este ridicată, hidrogenul este ușor eliberat și se formează produse solubile de coroziune. În intervalul de pH 4.0-8.5, viteza de coroziune a acestor metale este constantă. La pH ≥ 10 se formează hidroxizi insolubili, iar viteza de coroziune scade drastic (Fig.1b).
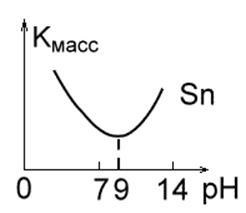
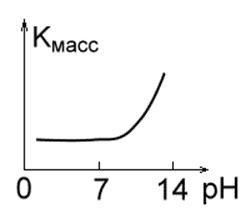
Fig. 1 in. Fig. 1 г.Рис. 1 zi
3. Metalele care sunt stabile în medii neutre, dar sunt distruse în soluții alcaline și acide din cauza amfoterității lor (Fig.1c). Acesta este Zn, Al, Sn, Pb. Acestea se caracterizează printr-o anumită valoare a pH-ului soluției, la care viteza de coroziune este minimă: Al - 7,0; Pb - 8,0; Sn-9,0; Zn = 10,0; Fe - 14,0.
4. Metalele care sunt stabile în mediu acid, dar instabil în mediu alcalin: Mo, Ta, W. (Figura 1).
5. Metale, rezistente la temperaturi scăzute în mediu acid, dar stabile în alcaline: Ni, Cd. (Figura 1 e).
Efectul presiunii asupra vitezei coroziunii electrochimice
Efectul presiunii este complex. Datorită creșterii vitezei de difuzie a oxigenului, coroziunea crește mai întâi, apoi viteza de coroziune scade, deoarece se formează o peliculă protectoare pe suprafața metalului. Viteza de coroziune crește brusc datorită îndepărtării mecanice a filmului de protecție prin fluxul în mișcare al electrolitului. Viteza de deplasare a electrolitului afectează mai puternic coroziunea cu depolarizarea oxigenului, decât cu hidrogenul.
Efectul compoziției electrolitului.
Pe măsură ce concentrația soluției crește, viteza de coroziune crește mai întâi și apoi scade. Creșterea coroziunii se explică prin creșterea conductivității electrice a soluției (întărirea reacției anodice), iar scăderea coroziunii este asociată cu o scădere a solubilității oxigenului.
Diferite abordări practice pentru protejarea materialelor împotriva coroziunii
Articole similare
Trimiteți-le prietenilor: