Stabilitatea termodinamică a unui compus dat este determinată de schimbarea energiei Gibbs AG atunci când se formează în condiții fizice date (p, T). Descompunerea acestui compus necesită costul aceleiași energii și determină astfel capacitățile acestui proces metalurgic.
În regiunea cu temperatură ridicată, compușii metalici cu oxidanți elementari (O, S, N, H) se pot descompune, eliberând oxidantul în faza gazoasă, de exemplu:
2FeOt * = ± 2Fetv - 02gas f •
Ecuațiile de reacție dintre metal și oxidant sunt în mod convenabil redactate ca o reacție de descompunere, determinând coeficienții ecuației astfel încât o moleculă de gaz să fie produsă pe partea stângă, de exemplu:
În acest caz, variația standard a energiei Gibbs AG0 va fi exprimată în ecuația generală pentru toate reacțiile.
AG ° = AH-TAs = - RTnN02, (9.1)
și deoarece expresiile pentru determinarea constantelor de echilibru vor fi identice, ele sunt convenabil comparate unele cu altele în determinarea direcției de interacțiune a compușilor între procesele metalurgice co-în procese. Un sistem eterogen în care
Acest echilibru există (Figura 9.1), va avea un grad de libertate: C = 2 + 2 - 3 = 1, adică,
p02 = MP sau T = / Ap02). (9.2)
Dependența AG asupra temperaturii în anumite limite (fără transformări de fază) variază liniar, iar logaritmul presiunii oxigenului va varia de-a lungul curbei, așa cum se arată în Fig. 9.2. Punctul de intersecție cu axa de temperatură va corespunde condiției:
AG ° = 0; lgA ^ O2 = 0 sau Nuc = 1 (9,3)
Sensul fizic este că la o temperatură T0, presiunea de oxigen de echilibru deasupra oxidului este egală cu presiunea externă a oxigenului pur, adică chiar și în oxigenul pur, metalul nu va fi oxidat. Pentru metalele active, această temperatură este foarte ridicată și se situează deasupra punctului de fierbere al metalului, iar metalele mai puțin active, cum ar fi cuprul, satisfac această condiție la temperaturi mai scăzute.
Aplicând ecuația simplificată pentru variația standard a energiei Gibbs AG0 (vezi § 8.3), putem obține următoarele ecuații pentru disocierea oxizilor:
2. Cu204Cu + 02; AG £ U20 = 334 720 - 150,37 T
2Fe + 02; ДСre0 = 527 360 - 114,75 Т;
Figura 9 1 Sistemul de interacțiune a metalului cu oxigenul
2MnO ^ 2Mn + 02; A0 ^ nO = 769 860 - 148,05 T; SiCWSi + 02; AGsi02 = 1 718 600-181,66 G; 2 / 3A12Oa ** 4 / 3A1 + 02; AG £, = 1 116600 - 209,11 T.
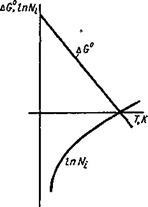
Fig. 9 2. Dependența DS ° și logaritmul presiunii de disociere a oxidului metalic la temperatură
Fig. 9 3 Variația DS ° în dependența de temperatura metalotermică pe AbO3, S1O2, reducerea oxizilor metalici la MnO, FeO, CU2O T = const
În Fig. 9 3 sunt grafice ale funcțiilor AG ° => (T). Stabilitatea termodinamică a oxizilor crește în seria de elemente Cu -> Fe - * - Mn - * Si - * - Al, dar în intervalul de temperatură 2500. 3000 K stabilitatea oxizilor Mn și Si se schimbă în locuri. Temperaturile la care dispare stabilitatea termodinamică sunt, respectiv, următoarele: Tcuo = 2230 K; 7Veo = 4600 K; 7'mo = 5200 K; Ts, 02 = 4730 K; GAI2o3 = 5330 K (este o aproximație obținută printr-un calcul foarte aproximativ).
Stabilitatea termodinamică variază în mod semnificativ în funcție de presiunea parțială a produsului de reacție gazos în mediu.
Dacă pentru un oxid de fier la o temperatură de 4600 K AGpe0 = 0 la o presiune p = 1,013-105 Pa, atunci la o presiune de P = 1,33 X X 10
2 Pa (10-4 mm Hg) ΔG0 va fi zero la temperatură
Diferitele stabilități termodinamice ale compușilor, de exemplu oxizii, permit reacții de reducere a oxidării între ele.
Luăm două vase izolate la T = const (figura 9.4). În unul dintre ele există un sistem 2AO * = ± 2A + Cbf, iar celălalt este 2BO = f ± 2B + 02f. Presupunem că AGA0> AGg0, iar presiunea de oxigen în echilibru este p ^<р'о2. Если сосуды соединить между собой, то кислород будет переходить от оксида ВО к металлу Айв результате получим восстановление металла В в результате окисления А:
Acest proces se numește metallothermal.
În mod analog, disocierea oxizilor poate fi considerată ca proces de disociere a sulfurilor, nitrurilor și hidrurilor de metale, care în aceeași măsură determină stabilitatea lor termodinamică. Atunci când sunt combinați cu oxidanți elementari (O, S, N, H, halogeni), elementele pot prezenta un grad diferit de oxidare și disocierea compușilor va avea loc pas cu pas de la cea mai înaltă stare de oxidare la oxidarea inferioară, de exemplu:
4 / 3Cr03 ^ 2 / 3Cr20s + 02f; 2Cr2035 = t4Cr0 + 02f; 2CyO2Cr +
2FeS2 ^ 2FeS + S2f; 2FeS ^ 2Fe + S2f;
SF6 ^ SF4 + F2f; SF4 ^ SF2 + F2t și așa mai departe.
Stabilitatea termodinamică a compușilor crește puternic, dacă acești compuși sunt în soluții.
Articole similare
-
Stabilitatea termodinamică - o enciclopedie mare de petrol și gaze, articol, pagina 1
-
Stabilitatea termodinamică și structura electronică a complexelor polimerice "sandwich"
-
Stabilitatea termodinamică - un complex - o enciclopedie mare de petrol și gaze, articol, pagina 1
Trimiteți-le prietenilor: