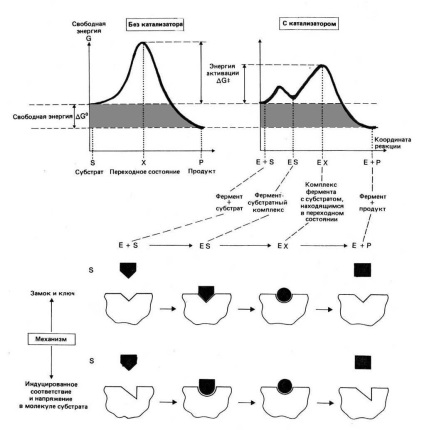
Pentru a forța substraturile să intre într-o reacție, este nevoie de energie, se numește energie de activare (ΔG ‡). Cu cât este mai mare energia de activare necesară, cu atât este mai mică viteza de reacție la o temperatură dată. Enzimele, care acționează ca și catalizatori, reduc energia de activare necesară pentru producerea unei reacții. Acestea măresc rata generală de reacție, fără a schimba într-o măsură semnificativă temperatura la care reacționează această reacție.
Enzima, care leagă substratul, formează un complex enzimatic-substrat de scurtă durată (complex E-S). Într-un astfel de complex, șansa ca reacția să se producă crește semnificativ. După terminarea reacției, complexul E-S se descompune într-un produs (sau produse) și o enzimă. Enzima nu se schimbă în reacție: la sfârșitul reacției, rămâne la fel ca înaintea ei și poate interacționa acum cu o nouă moleculă de substrat.
Enzima + Substrat → Complex E-S → Enzime / Produs (e)
Metode pentru creșterea ratei de reacție a enzimelor
Scăderea energiei libere a stării de tranziție prin stabilizarea complexului activat.
O creștere a energiei substratului, când se leagă de enzimă când se formează complexul E-S. Ca rezultat, diferența dintre energiile libere ale complexului E-S și starea de tranziție scade.
Sprijinirea microenvironmentului centrului activ într-o stare diferită de cea din mediul acvatic. Adesea, lanțurile laterale ale resturilor de aminoacizi situate în regiunea centrală activă, capacitatea de a dobândi o sarcină electrică variază în comparație cu cazul în care aceste lanțuri sunt imersate într-un mediu apos. Ca urmare, lanțurile laterale pot avea "reactivitate crescută".
Aranjamentul atomilor de reacție în orientarea corectă și la distanța necesară între ele, astfel încât să se asigure cursul optim al reacției. Coliziuni de atomi în absența unei enzime foarte rar duc la o reacție chimică, deoarece în acest caz foarte rar atomii se dovedesc a fi în orientarea corectă.
Centrul activ
Molecule majorității enzimelor este de multe ori mai mare decât moleculele substraturilor, care activează enzima și în contact cu substratul în E-S-complex intră doar o mică parte a moleculei de enzimă - în mod tipic 3 până la 12 resturi de aminoacizi. Deși aceste reziduuri sunt apropiate spațial împreună, acestea sunt deseori foarte îndepărtate una de cealaltă în secvența liniară de proteine.
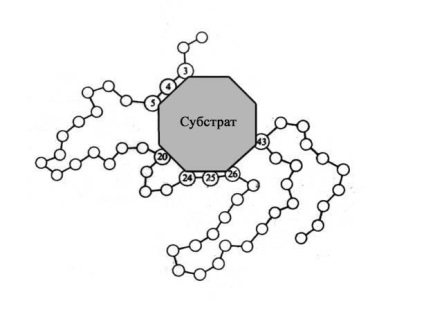
Fig. 11 Reprezentarea schematică a complexului E-S (substratul este atașat la enzima în centrul activ al acestuia din urmă).
Această parte a moleculei enzimei se numește centrul activ. Aici se află substratul sau substraturile.
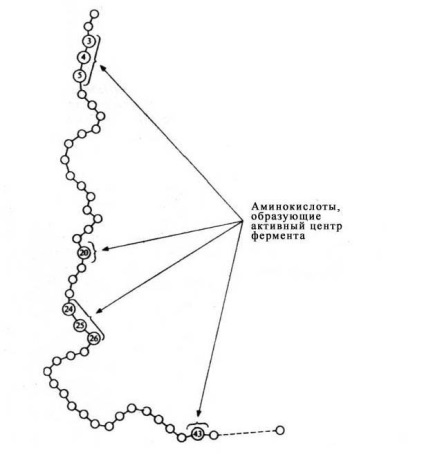
Fig. Poziția resturilor de aminoacizi care formează centrul activ al enzimei în structura primară a proteinei enzimatice).
Rolul altor resturi de aminoacizi, care constituie cea mai mare parte a enzimei este de a asigura forma corecta molecula globulare, care este esențială pentru situsul activ al enzimei poate lucra mai eficient.
De obicei, formarea de E-S-complex are loc fără formarea de legături covalente, dar în detrimentul tipurilor slabe, dar mai specifice de interacțiune, cum ar fi legături de hidrogen, punți de sare, forța hidrofobe și împachetarea dens de atomi.
Articole similare
Trimiteți-le prietenilor: