Enzimele reduc energia de activare a reacției chimice - secțiunea Filosofie, Lectura 3 - Enzime. Structura, mecanismul de acțiune, clasificarea 1) Cum și orice catalizatori, enzime măresc viteza de chem.
1) Ca orice catalizator, enzimele măresc rata de reacție chimică datorată scăderii energiei de activare a reacției (barieră energetică) a reacției.
2) Scăderea energiei de activare pentru cataliza enzimatică se datorează creșterii numărului de etape ale procesului chimic.
Inducerea unui număr de pași intermediari conduce la faptul că energia de activare barieră sursă (Ea) este împărțită în mai multe bariere de energie de activare inferioară sunt depășite molecule reactive pot mai repede decât baza.
3) Substraturi enzime contribuie ia starea de tranziție prin legarea de energie în formarea complexului enzimă-substrat. Astfel, energia (Ea) este eliberată în formarea de legături de hidrogen între substrat și enzimă la un substrat de fixare pe suprafața enzimei. care se cheltuiește pe transferul moleculelor de substrat în starea activă.
Înregistrarea condiționată a reacției de formare și funcționare a complexului enzimă-substrat este după cum urmează:
E + S ↔ ES → EP → E + P
Atunci când enzima interacționează cu substratul, se pot distinge trei etape:
1. Prima etapă: formarea unui complex enzimatic-substrat,
adică atașarea substratului la macromolecul enzimei.
2. A doua etapă. reacție directă enzimatică.
3. A treia etapă. separarea produselor de transformare a substratului din enzimă.
Prima etapă este formarea unui complex enzimatic-substrat
(E + S ↔ ES):
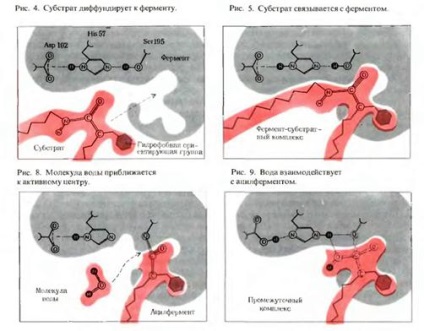
1) reacția enzimei cu un substrat precede convergența și orientarea substratului în raport cu situsul activ al enzimei.
2) Se formează apoi complexe enzimă-substrat (ES).
Mecanism subțire de formare a complexului enzimă-substrat:
a) formarea complexului enzimă-substrat modifică în mod reversibil structura terțiară (conformația) a enzimei. care promovează cea mai bună corespondență spațială a moleculelor de enzime și substrat (Figura 3.5):
Articole similare
Trimiteți-le prietenilor: