Lucrarea de laborator 3. Efectul termic al reacției de neutralizare
Scopul lucrării. Pentru a stăpâni metoda de măsurare calorimetrică; determină efectul termic al reacției de neutralizare a acidului sulfuric cu alcaline; pentru a stăpâni calculele termochemice.
Procesul chimic. Acidul sulfuric poate fi neutralizat în două moduri. Prima metodă este neutralizarea secvențială în două etape.
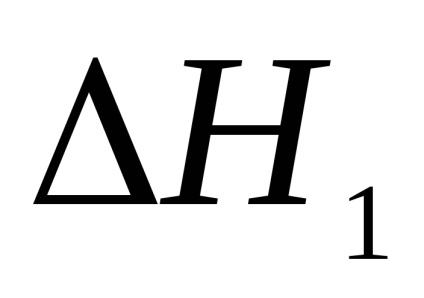
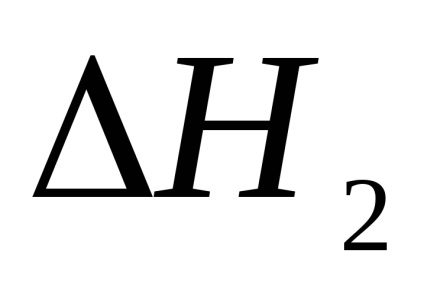
A doua metodă este neutralizarea completă a acidului sulfuric într-o singură etapă.
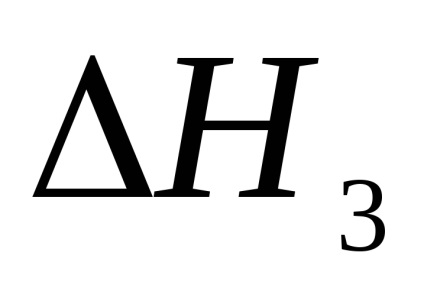
Trebuie luat în considerare faptul că acidul sulfuric este un acid slab în a doua etapă de disociere cu Kdis = 1,2 · 10-2.
Partea experimentală. Determinarea efectului termic al reacției a fost făcută de un instrument numit un calorimetru. Cea mai simplă dintre acestea este prezentată în Figura 2.
Experiență 1. Neutralizarea acidului sulfuric în două etape.
În
Experimentul 2. Neutralizarea acidului sulfuric într-o singură etapă.
S-a turnat o soluție de acid sulfuric de 50 cm3 într-un pahar calorimetric. Am măsurat temperatura (t1). Cilindrul a fost umplut cu 50 cm3 dintr-o soluție 2M de NaOH alcalin. Într-o soluție de acid rapid și fără pierderi turnate din cilindrii alcalini. Soluția rezultată a sării medii de Na2S04 a fost agitată prin agitare. Am măsurat temperatura maximă (t2). Rezultatele experimentului sunt prezentate în Tabelul 1.
experiență I (1,2) experiență II (3)
Rezultatele experienței de procesare
Căldura eliberată ca urmare a reacției de neutralizare este calculată prin formula
,

unde
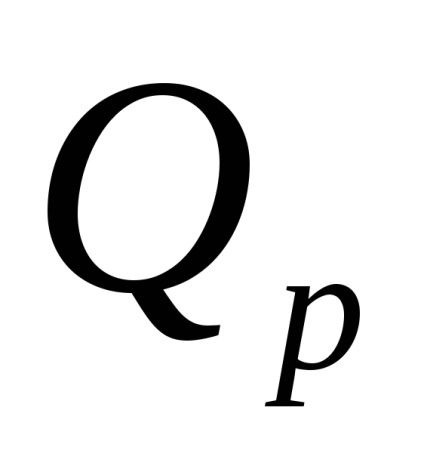




10 -3 - factorul de conversie J în kJ.
Administrarea de o căldură specifică eficientă a soluției, datorită faptului că căldura de neutralizare de reacție este consumată nu numai pentru încălzirea soluției, dar și încălzirea pereților interiori ai colorimetru (cupa de sticlă), în care greutatea acestei părți a sistemului este strict nu vorbind cunoscut pentru a încălzi un termometru, evaporarea apei cu creșterea temperaturii soluției etc. Din cauza relativ mici cantități de acizi sau baze acești factori în mod semnificativ, luând în calcul și acest efect este introdus așa-numita „calorimetru constantă“, care, în cazul nostru se înlocuiește cu capacitatea termică efectivă a fluidelor.
1. Calcularea efectului termic al primei și celei de-a doua etape a reacției de neutralizare în primul experiment.
2. Calculul efectului termic al reacției de neutralizare în cel de-al doilea experiment.
3. Pe baza efectului legii, Hess a calculat efectul termic teoretic al reacției neutralizării acidului sulfuric cu alcaline, la căldură cunoscută de formare a produselor de reacție și a materiilor prime, care sunt date în Tabelul 2.


Datorită faptului că diferența dintre efectele termice din ambele experimente este nesemnificativă, putem concluziona că consecința legii lui Hess este satisfăcută.
Concluzie: În cursul lucrărilor de laborator, am însușit măsurare calorimetrică tehnica captate calcule termochimice determinat efectul termic reacție de neutralizare a acidului sulfuric cu alcalii în două moduri. Efectul termic în primul experiment a fost egal; în al doilea experiment -; efectul termic teoretic a fost de 31,82 kJ. A confirmat împlinirea anchetei legii lui Hess. Eroarea relativă în primul experiment este de 2,85%, în al doilea - 7,41%; eroarea absolută din primul experiment este -
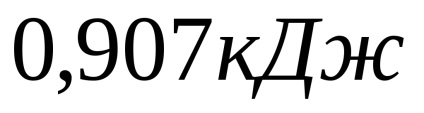
Articole similare
Trimiteți-le prietenilor: