Soluțiile ocupă o poziție intermediară între amestecurile mecanice de substanțe și compușii chimici individuali, care posedă anumite proprietăți ale ambelor sisteme și în același timp diferă semnificativ de la fiecare dintre acestea.
Astfel, în comparație cu amestecurile, soluțiile sunt mai omogene și în orice parte au aceleași proprietăți fizice și compoziție chimică ca și compușii individuali.
În același timp, multe substanțe din soluții, cum ar fi amestecurile mecanice, păstrează unele dintre proprietățile inerente în forma lor pură. Spre deosebire de soluțiile compușilor individuali au o compoziție variabilă și natura legăturii diferite între unitățile sale structurale. În cazul în care substanțele chimice sunt legături covalente și ionice caracteristice, soluțiile dintre componentele lor sunt prezente mai slabe dipol-dipol, ioni-dipol sau van der Waals interacțiuni, iar în unele cazuri - legături de hidrogen, interacțiuni donor-acceptor.
Astfel, procesul de dizolvare nu poate fi privit ca o distribuție mecanică simplă a unei substanțe în alta.
Dmitri Ivanovici Mendeleev
(1834-1907).
Într-adevăr un mare om de știință. Nu, se pare, nu există un singur domeniu de chimie la care să nu fi contribuit. Cel mai faimos de funcționare, cu excepția legii periodice, această descoperire „temperatură de fierbere absolut“ (punctul critic), dezvoltarea teoriei fizice și soluție chimică (hidrat), formularea unei legi a gazelor generalizate. O altă activitate importantă a vieții sale, DI Mendeleyev, a considerat manualul "Fundamentele chimiei".
Când se dizolvă, are loc interacțiunea fizico-chimică a substanței dizolvate cu moleculele de solvent, ca urmare a distrugerii structurii sale originale și formarea unei noi structuri inerente soluției. În acest caz, se disting etapele fizice și chimice ale dizolvării substanței, care se desfășoară simultan.
În stadiul fizic există un proces de măcinare (dispersare) a substanței dizolvate pentru a separa moleculele sau ionii și distribuția uniformă a acestora în întregul volum al soluției. Ea se realizează datorită acțiunii moleculelor de solvenți asupra substanței și cursului procesului de difuzie.
În acest stadiu, energia este întotdeauna consumată, pentru că este necesar pentru ruperea legăturilor în rețeaua cristalină a unor legături solide sau intermoleculare în timpul dizolvării unui lichid.
Să arătăm mecanismul acestui proces prin exemplul dizolvării în H2O a sarii KCl, care are o latură de cristal ionic (Figura 18).
dipoli solvent orientat relativ corect la ionii cu zăbrele cristaline pe suprafața sa și, ca rezultat al mișcării lor termice și a oscilațiilor ionilor secvențial le trage din punctele de zăbrele și adus în soluție.
Cu cât legătura este mai puternică în rețeaua cristalină, cu atât mai multă energie trebuie să fie folosită pentru ao distruge. Legăturile intermoleculare în lichide sunt, de regulă, mai slabe decât în solide, deci atunci când dizolvă energia,
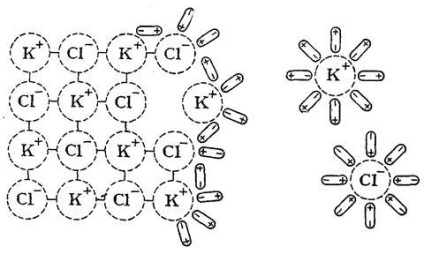
Fig. 18. Mecanismul de dizolvare a compusului ionic (KCl) în apă
mult mai puțin. În gaze, moleculele nu au nicio legătură, astfel încât energia nu este consumată în stadiul fizic al dizolvării lor.
La etapa de reacție de dizolvare chimică are loc particulelor de solut (molecule sau ioni) cu moleculele de solvent și compuși chimici sunt formați: hidrati (când reliefează H2O ca solvent) sau solvații acestora (în cazul în care acționează ca solvent orice alt lichid).
În funcție de natura solvaților solut (hidrații) pot fi produși ca rezultat al interacțiunilor fizice: ion-dipol (când se dizolvă substanțe ionice cu structură) și dipol-dipol (atunci când este dizolvat substanțe cu structură moleculară) și chimice.
Interacțiunile chimice se realizează datorită formării legăturilor donor-acceptor. În acest caz, ionii solutului sunt acceptori, iar moleculele de solvent (H2O, NH3) sunt donatori de perechi de electroni. Hidrații formați în acest fel se mai numesc acvacomplexuri. [Cu (H2O) 6] 2+. [Al (H20) 6] 3+. Formarea lor în soluții este adesea însoțită de o schimbare a culorii. Astfel, dizolvarea sulfatului de cupru anhidru (II) de culoare albă are ca rezultat o culoare albastră intensă. Cojile hidratate ale moleculelor polare ale compușilor organici apar ca urmare a formării legăturilor de hidrogen între grupurile lor funcționale și moleculele de apă.
Datorită formării hidraților (solvați) prin dizolvarea multor substanțe se produce contractarea - volumul de sisteme de comprimare, datorită auto-etanșare (în special în cazul soluțiilor concentrate). În acest caz, volumul soluției rezultate va fi mai mic decât suma volumelor de solvenți și solutanți (cu excepția cazului în care acesta din urmă este un gaz).
Formarea cojilor hidratat (solvat) este întotdeauna însoțită de eliberarea de energie. Atunci când ionii sunt hidratați, cantitatea de energie eliberată și numărul de molecule de apă reținute depind de amploarea încărcării și a razei lor.
Cu cât încărcarea cu ioni este mai mare și cu cât este mai mică raza acesteia, cu atât este mai mare cantitatea de energie eliberată și cu cât structura de hidrat este mai stabilă (Figura 19).
Fig. 19. Dependența mărimilor cojilor hidratați ai ionilor de dimensiunea razei lor
Dacă substanța în soluție este sub formă de molecule, cantitatea de energie eliberată în timpul hidratării este proporțională cu polaritatea moleculelor sale.
În timpul mișcării termice, particulele substanței dizolvate în soluție se deplasează împreună cu cojile lor hidratate (solvat), care formează un singur întreg cu ele.
În majoritatea cazurilor, cojile formate hidratate (solvat) sunt fragile și distruse ușor chiar și cu încălzire ușoară sau cu precipitarea substanțelor din soluție. Dar, uneori, compușii hidrați sunt atât de stabili încât scapă din soluție sub formă de cristale, care altfel sunt denumite hidrați cristalini. iar H20 conținută în ele este cristalizarea.
În formulele chimice ale hidraților cristalini moleculele H2O sunt scrise printr-un punct (Tabelul 5). Din aceste formule este clar cât de multe molecule de H2O înconjoară o moleculă de materie.
Tabelul 5. Formule și denumiri triviale de hidrați cristalini
Când sunt încălzite (uneori suficient de puternice), hidrații cristalini sunt distruși și H2O de cristalizare se evaporă.
Etapele fizico-chimice ale procesului de dizolvare se desfășoară simultan. Efectul termic total în dizolvarea unei substanțe este determinat de relația dintre aceste două etape.
Dacă se consumă mai multă energie în stadiul fizic al energiei decât este eliberată în stadiul chimic, atunci când substanța se dizolvă, temperatura soluției va scădea și energia va fi consumată în ansamblu. Acest lucru este observat, de exemplu, când NaCI, NH4N03 este dizolvat.
Dacă la pasul energia fizică este consumată mai mică decât alocată etapei chimice, aceste substanțe dizolvate atunci când temperatura soluției, dimpotrivă, va crește, și energie, în general, să fie alocate. Acest lucru este valabil mai ales când NaOH, KOH, H2SO4 sunt dizolvate în apă.
Dacă, în stadiul fizic, aproximativ aceeași cantitate de energie consumată ca fiind alocată substanței chimice, temperatura soluției în timpul dizolvării unei astfel de substanțe nu se va schimba practic.
La dizolvarea gazelor, căldura este întotdeauna eliberată; în stadiul fizic, energia nu este irosită.
Efectele termice ale dizolvării majorității substanțelor sunt nesemnificative, de aceea, de regulă, nu se observă încălzire sau răcire considerabilă a soluțiilor. Totuși, în unele cazuri, de exemplu, prin dizolvarea în hidroxizi de H2O a metalelor alcaline sau H2S04. există o încălzire atât de mare a soluției încât poate chiar fierbe. Prin urmare, atunci când se prepară soluții apoase de acizi și alcalii, este necesară o atenție deosebită. În special, atunci când se prepară o soluție diluată de H2S04, un acid concentrat în H20 trebuie adăugat în porții mici și nu invers.
Când se dizolvă NaCI sau NH4N03, temperatura soluției poate scădea la minus.
Căldura eliberată sau absorbită prin dizolvarea a 1 mol de substanță se numește căldura de dizolvare (Q).
Solubilitatea substanțelor.
Factorii care afectează solubilitatea
Unele substanțe se dizolvă mai bine într-un solvent sau altul, altele sunt mai rău. Se crede că nu există absolut nici o substanță insolubilă. Fiecare substanță este capabilă să se dizolve, chiar și în unele cazuri și în cantități foarte mici (de exemplu, mercur în apă, benzen în apă).
Din păcate, până în prezent, nu există o teorie prin care să fie posibil să se prevadă și să se calculeze solubilitatea oricărei substanțe într-un solvent adecvat. Acest lucru se datorează complexității și varietății interacțiunii dintre componentele soluției și absenței unei teorii generale a soluțiilor (în special soluții concentrate). În acest sens, datele necesare privind solubilitatea substanțelor sunt obținute, de regulă, prin experiment.
Din punct de vedere cantitativ, capacitatea unei substanțe de a se dizolva este cel mai adesea caracterizată prin solubilitatea sau coeficientul de solubilitate (S).
Solubilitatea (S) arată cât de multe grame de substanță se dizolvă cât mai mult posibil în condițiile date (temperatură, presiune) în 100 g de solvent pentru a forma o soluție saturată.
Dacă este necesar, factorul de solubilitate este de asemenea determinat pentru o altă cantitate de solvent (de exemplu, pentru 1000 g, 100 cm3, 1000 cm3, etc.).
Prin solubilitate, toate substanțele, în funcție de natura lor, sunt împărțite în 3 grupe: 1) foarte solubile; 2) puțin solubil; 3) slab solubil sau insolubil.
Coeficientul de solubilitate pentru substanțele din primul grup este mai mare de 1 g (pentru 100 g de solvent), pentru substanțele din al doilea grup se află în intervalul 0,01-1,0 g, iar pentru substanțele din al treilea grup S <0,01 г.
Solubilitatea substanțelor este influențată de mulți factori, dintre care principalul sunt natura solvenților și a substanțelor dizolvate, temperatura, presiunea, prezența în soluție a altor substanțe (în special a electroliților).
Articole similare
Trimiteți-le prietenilor: