Soluția este un sistem omogen în care sunt prezente mai mult de 2 substanțe. Pot fi compuși: gaz - lichid, gaz - solid, lichid - solid și pot fi amestecuri omogene.
Această substanță, care, în exces, este de obicei numită solvent. dar ceea ce este în cantitate mică este o substanță dizolvată.
Clasificarea soluțiilor.
1. În funcție de starea de agregare, se disting soluțiile:
Soluțiile gazoase sunt amestecurile de aer și alte gaze.
Soluțiile lichide sunt soluții omogene de lichide, solide și gaze.
Soluții solide - aliaje.
Solvenți: apă. Benzen, alcooli, eteri, acetonă etc.
În timpul dizolvării, soluțiile de ioni ai substanței solubile sub acțiunea particulelor de solvent care se mișcă în mod aleatoriu trec în soluție, rezultând formarea unui nou sistem omogen.
Abilitatea de a forma în diferite soluții este exprimată în moduri diferite: unele se pot amesteca unele cu altele, în timp ce altele nu pot. De exemplu, dizolvarea sării de masă în apă:
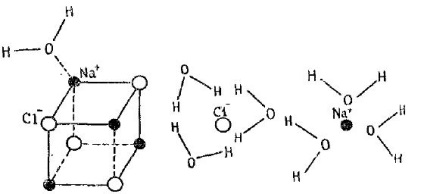
Apa este un solvent polar, oxigenul poate atrage o pereche de electroni de Na-Cl.
Ca urmare a mișcării vibraționale, unele dintre moleculele de sare trec în soluție (în apă), ca rezultat al deschiderii următorului strat al cristalului. Treptat, astfel, toate straturile ajung în soluție, ca urmare a dizolvării cristalului, iar apa dobândește un caracter sărăcitor. Ca urmare a difuziei, particulele care au trecut în soluție sunt distribuite în întregul volum al solventului.
Dizolvarea este întotdeauna însoțită de un proces invers - cristalizare. S-ar putea să vină un moment în care din soluție să se elibereze cât mai multe particule pe măsură ce trece în soluție (procesele se desfășoară simultan), rezultând astfel un echilibru.
- saturat (Această soluție, în care substanța la o anumită temperatură se dizolvă nu mai, adică echilibrul se observă, iar procesul este titlul de saturație O astfel de soluție include numărul maxim de solut ...);
- nesaturat;
- suprasaturate (sisteme instabile de echilibru în care se observă o tranziție arbitrară la o stare de echilibru, în timp ce excesul de substanță dizolvată este eliberat și soluția devine saturată).
2. În funcție de numărul substanțelor dizolvate, se disting soluțiile:
- soluții concentrate;
- soluții diluate (cantitate mică de substanță dizolvată).
3. Natura soluțiilor de substanțe sunt:
- soluții moleculare (non-electrolitice);
- ionice (soluții de electroliți, conducând electricitate).
Articole similare
Trimiteți-le prietenilor: