Ecuația lui van der Waals conectează parametrii termodinamici de bază pentru un gaz real.
La presiuni scăzute și la temperaturi înalte, legea lui Mendeleev-Clapeyron descrie destul de precis comportamentul gazelor reale, dar în alte condiții, gazele reale deviază semnificativ de la idealitate. Ecuația lui van der Waals ia în considerare aceste abateri.
Formula ecuației lui Van der Waals
Ecuația lui van der Waals are forma:
În această ecuație, n este numărul de moli de gaz, p este presiunea sa. V este volumul ocupat de gaz și T este temperatura absolută a gazului. Condiția universală a gazului are o valoare de 8,31441 J / (mol • K), care este aceeași pentru toate gazele.
Variabila a este corecția forței de atracție dintre moleculele de gaze. Sub acțiunea acestei forțe, moleculele sunt atrase unul de celălalt, în interiorul gazului, reducând presiunea pe perete. Variabila b este o corecție care ține cont de volumul intrinsec ocupat de moleculele de gaze. Aceste corecții depind de tipul de gaz și pot fi găsite din tabele sau calculate conform următoarelor formule:
Aici u este presiunea și temperatura absolută a gazului în punctul critic, adică în punctul de tranziție al fazei gazoase în faza lichidă.
Într-un gaz real, distanțele dintre molecule sunt mai mici decât în gazul ideal și sunt comparabile cu dimensiunile moleculelor. Prin urmare, forțele de interacțiune dintre molecule devin suficient de mari. În volumul de gaz, molecula este înconjurată pe toate laturile de alte molecule, iar forțele atracției lor sunt echilibrate. Cu toate acestea, atunci când molecula se apropie de perete, forțele de atracție nu mai sunt echilibrate și "trase" spre interior. Prin urmare, molecula se mișcă mai încet pe perete, din cauza căreia presiunea pe perete scade. Acest lucru este luat în considerare de amendamentul a.
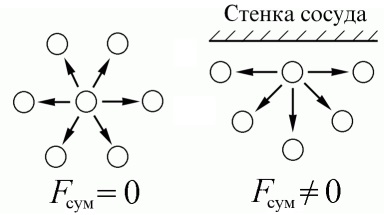
În plus, datorită forțelor de interacțiune intermoleculară, gazele reale sunt capabile să treacă la o stare lichidă, iar ecuația lui van der Waals descrie destul de precis comportamentul gazelor din vecinătatea acestei tranziții.
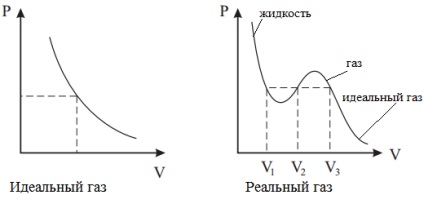
Întrucât într-un gaz real distanța dintre molecule este relativ mică, molecula trebuie să zboare la o distanță mai mică pentru a lovi peretele. Prin urmare, la presiuni foarte mari, presiunea pe perete crește și aceasta ține cont de corecția b.
Ecuația lui Van der Waals este utilizată, în special, pentru determinarea parametrilor de abur în ingineria termică și în ingineria termică, atunci când se studiază lichefierea gazelor.
Exemple de rezolvare a problemelor
Ce temperatură are azotul o masă de 2 grame, ocupând un volum de 800 cm la o presiune de 0,2 MPa, dacă este privită ca un gaz real?
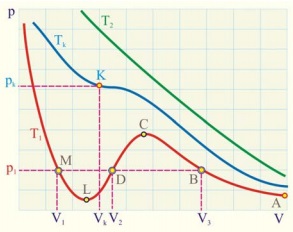
Înmulțind ecuația lui Van der Waals și împărțind-o cu p, obținem o ecuație cubică în raport cu volumul:
Această ecuație are trei rădăcini. La punctul de inflexiune arătat în figură, toate aceste rădăcini sunt reale și egale una cu cealaltă. Punctul de inflexiune este punctul critic la care faza gazoasă trece în faza lichidă.
Pentru a găsi parametrii critici, folosim proprietățile punctului de inflexiune: primul și al doilea derivat al ecuației dispare.
Rezolvăm aceste ecuații în ceea ce privește volumul și temperatura, obținem parametrii critici:
Exprimând presiunea din ecuația lui van der Waals și scriind această ecuație pentru parametrii critici, obținem:
Înlocuim această ecuație, iar după ce obținem soluția:
Se scrie sistemul de ecuații:
Din aceasta gasim:
Înlocuind b în a doua ecuație a sistemului, obținem:
Articole similare
Trimiteți-le prietenilor: