una dintre primele ecuații de stare a unui gaz real. Propusă în 1873 goll. fizicianul J. D. van der Waals. Pentru molul unui gaz având un volum V la o temperatură T și o presiune p, are forma:
unde R este constanta gazului universal. și a și b sunt experimente. Constante care iau în considerare abaterea lui sv - în gazul real de la soare la ideal. Astfel, termenul a / V2 are dimensiunea presiunii și ia în considerare atracția moleculelor ca urmare a interacțiunii intermoleculare, iar constanta b este corecția pentru sine. volumul de molecule, care ia în considerare repulsia moleculelor la distanțe apropiate. Pentru variantele mari V (și, de asemenea, pentru gazele rarefied) constantele a și poate fi, de asemenea, neglijat. merge în ecuația stării unui gaz ideal (vezi EQUATIONUL KLAIPEIRON).
B. y. yavl. determină în mod aproximativ și cantitativ proprietățile gazelor reale numai în regiunea de înaltă T și joasă p. Cu toate acestea, calitativ ne permite să descriem comportamentul unui gaz la o înaltă p, la condensarea gazului și la gazul critic. de stat.
Figura prezintă izotermele calculate de la UV. La T scăzut, toate cele trei rădăcini ale lui B. sunt reale, iar cele de mai sus sunt critice. tempo (Tk) există o singură valabilitate. rădăcină. Aceasta înseamnă că la T> TK cantitatea poate exista numai într-o singură stare (gazoasă), iar pentru T
- ecuația de stare a unui gaz real. Propusă de către J. D. van der Waals în 1873. Pentru un gaz care conține molecule N, W. v. are forma:
unde V este volumul, p este presiunea și T este abs. gaz a-pa, a și b sunt constante luând în considerare atracția și respingerea moleculelor. Termenul este numit. ext. presiunea, b constantă este egală cu volumul cvadruplu al moleculei de gaz, dacă luăm sfere elastice cu atracție slabă ca model al moleculei.
B. y. determină cantitativ proprietățile gazelor reale numai într-un interval mic T și p într-o regiune relativ mare T și p scăzută, deoarece a și b sunt temperaturi. Cu toate acestea, V. Yu. descrie din punct de vedere calitativ comportamentul gazului și lichidului la p ridicat, precum și caracteristicile tranziției de fază dintre ele. La presiuni scăzute și temperaturi relativ înalte, se trece în starea gazului ideal (ecuația Clapeyron), iar la presiuni mari și temperatură scăzută, se ia în considerare compresibilitatea scăzută a lichidelor. B. y. În plus, descrie starea critică și metastabilă a sistemului de vapori lichizi.
În Fig. Izotermele calculate în coordonatele p - care este cubic cu privire la V. Există 3 cazuri posibile de soluționare a a. 1) toate cele trei rădăcini sunt reale și egale; acest caz corespunde criticului. (izotermă Tcp; 2) toate cele trei rădăcini sunt reale și diferite - așa-numitele. dokritich. stare (izoterme la T
Geom. localizarea punctelor inițiale și finale ale "echilibrului" a și a fazelor stabile și metastabile (determinate din condiția de egalitate a zonelor umbrite) se numește. binodal (curba aKc). Se numește o curbă care unește punctele extreme de tip d și e. spinodal (curba dKe). Regiunea cuprinsă între binodală și spinodal este regiunea stării instabile, metastabile a sistemului. T. despre. izotermele tipului ad și ec se referă la echilibrul metastabil al lichidului supraîncălzit și, respectiv, al sistemului de gaz lichid. precum și un sistem de gaz + lichid și un gaz supracooleat. Site-ul dbe nu are nici fizic. sens, deoarece în această secțiune, cu creșterea p, crește V, ceea ce este imposibil.
La temperatură suficient de scăzută, regiunea adb scade sub izobar p = 0. În acest caz, având un fizic. adică anunțul site-ului va cădea în zona negativă. presiune, care corespunde stării instabile a lichidului întins.
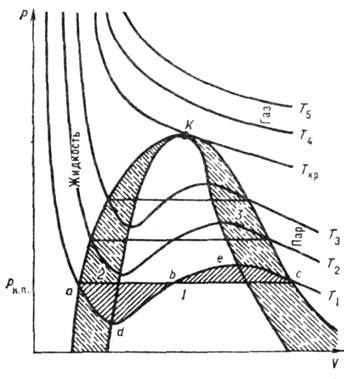
Schema de fază a substanței în coordonatele p-V: T1 Cu ajutorul lui V. Yu. puteți deveni critic. parametrii pcr. V cr și Tcp. În punctul K, izotermele Van der Waals au atât un punct maxim cât și un punct de inflexiune, adică .. Soluția sistemului de ecuații Van der Waals și cele două de mai sus este: În ciuda faptului că constanta b are un caracter de potrivire, dimensiunile moleculelor obținute prin intermediul expresiei. sunt în acord cu cele obținute prin alte metode. B. y. în care sunt introduse. din cantitatea T / Tcr. p / pcr. T / T cr, numit. starea redusă a statului; Are o aplicație mai largă decât UV. Dacă este în VU. presiunea este extinsă în puterile densității și în comparație cu expansiunea virială, atunci constantele a și b pot fi exprimate în termeni de coeficienți viriali. Lit. a se vedea art. Gaz. Yu H. Lyubitov
Articole similare
Trimiteți-le prietenilor: