Folosind ecuația de stare, se poate găsi dependența presiunii gazului la temperatură la un volum constant. Această dependență a stabilit experimental fizicianul francez Jacques Charles (1746-1823) în 1787 * Cu ecuația de stare a unui gaz ideal, să recurgă la experiența nu mai este necesară.
Legea lui Charles
Conform ecuației (3.9.9)
Presiunea unei mase date de gaz la un volum constant este direct proporțională cu temperatura absolută. Aceasta este legea lui Charles.
Din legea lui Charles rezultă că raportul dintre presiunile unei mase date de gaz la un volum constant este egal cu raportul dintre temperaturile sale absolute:
Procesul de schimbare a presiunii gazului cauzat de o schimbare a temperaturii la un volum constant este numit izochoric (din cuvintele grecești isos - egal și chora - spațiu ocupat). Dependența presiunii gazului asupra temperaturii este reprezentată grafic printr-o linie dreaptă-izochorică. Diferitele izocore corespund volumelor diferite (Figura 3.14). Deoarece odată cu creșterea volumului de gaz la o temperatură constantă, stropii de presiune (legea lui Boyle), al isochor corespunzătoare V2 volum este sub isochor volumul V1 corespunzător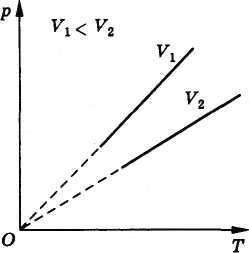
Toate liniile drepte se termină la origine. Prin urmare, presiunea unui gaz ideal la zero absolută este zero, ca și volumul.
Invităm cititorul să verifice singură că legea lui Charles poate fi scrisă sub forma
unde p0 este presiunea gazului la temperatura T = 273 K, iar coeficientul γ, numit coeficientul de temperatură al presiunii gazului, este egal cu coeficientul de temperatură al expansiunii volumetrice:
Coeficientul γ este schimbarea relativă a presiunii când temperatura gazului se modifică cu 1 K.
Termometru gaz cu volum constant
În secțiunea 3.6 am vorbit despre o scară ideală pentru temperatura gazului. Pentru a determina temperatura pe această scală, se utilizează termometre cu gaz. Cel mai simplu termometru cu gaz este un termometru cu volum constant. Măsurarea temperaturii folosind acest termometru se bazează pe legea lui Charles (3.10.2).
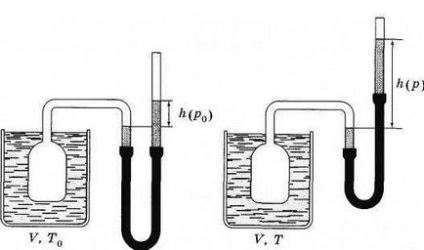
Un termometru cu gaz este un vas umplut cu un gaz: azot, argon sau heliu. Vasul este conectat printr-un tub flexibil la un manometru cu mercur, care măsoară presiunea gazului și își menține volumul constant (figura 3.15, a, b). În primul rând, presiunea este măsurată la o anumită temperatură fixă T0 (vezi figura 3.15, a) *. Presiunea este apoi măsurată la o temperatură T (vezi figura 3.15, b). Cunoscând presiunea p0 la temperatura și presiunea p la temperatura T, temperatura T este determinată din formula
* Această temperatură este de obicei aleasă ca fiind temperatura punctului triplu de apă, adică temperatura stării în care gheața, apa și vaporii de apă sunt în echilibru termic.
Un termometru pentru măsurători exacte este un dispozitiv foarte complex. Pentru a măsura temperatura în studiile fizice, este rar folosit. Scopul său principal este utilizarea pentru calibrarea unor termometre secundare mai simple. Această calibrare se efectuează în biroul de standarde, în institutele metrologice și în laboratoarele fizice individuale. Pentru calibrarea termometrelor convenționale, utilizate pe scară largă, se utilizează termometre secundare.
Cu privire la legea lui Charles, pentru a determina temperatura pe o scară ideală de gaz, se utilizează un termometru cu gaz.
Articole similare
-
Funcționarea dreptului penal în spațiu, în timp și într-un cerc de persoane
-
Legea încalcă compania dând alcool atunci când cumpără o brichetă sau alte lucruri mici
-
Articolul 33 din legea "Cu privire la poliție" în Federația Rusă cu observații
Trimiteți-le prietenilor: