Factorii care afectează POS-ul
CMC depinde de mai mulți factori, dar depinde în primul rând de structura radicalului de hidrocarburi, de natura grupului polar, de aditivii la soluția diferitelor substanțe și de temperatură.
Lungimea radicalului hidrocarbonat R.
Pentru soluțiile apoase, în seria omologă pentru omologii vecini, raportul CMR ≈ 3,2 are valoarea coeficientului de regulă Duclo-Traube. Cu cat mai mult R, cu atat energia sistemului scade cu formarea micelilor, deci cu cat radicalul de hidrocarburi este mai lung, cu atat CMC este mai mic.
Capacitatea de asociere se manifestă în molecule de surfactant la R> 8-10 atomi de carbon. Ramificația, nelimitatea, ciclizarea descrește tendința spre MCE și ↑ CMC.
Prezența grupurilor ionice mărește solubilitatea agenților tensioactivi în apă, astfel încât se pierde mai puțină energie ionică pentru micelii decât pentru moleculele neionice. Prin urmare, CMC pentru surfactanții ionici este de obicei mai mare decât pentru surfactanții neionici, cu aceeași hidrofobicitate a moleculei (numărul de atomi de carbon din lanțuri).
Efectul aditivilor de electroliți și substanțe organice polare.
Introducerea electroliților în soluții de IPAI și NIPAV provoacă un efect diferit:
1) în soluții de IPAI ↑ Salt- ↓ KKM.
Rolul principal este jucat de concentrarea și încărcarea contraionilor. Ionii încărcați cu același nume cu ionul SAW din MC au un efect redus asupra CMC.
Simplificarea MCE se explică prin comprimarea stratului difuz al contraionilor, suprimarea disocierii moleculelor SAW și deshidratarea parțială a ionilor SAW.
Reducerea încărcării micelilor slăbește repulsia electrostatică și facilitează atașarea de molecule noi la micelă.
Adăugarea de electroliți la ISS NIPAV are un efect redus.
2) Adăugarea de substanțe organice la soluțiile apoase de surfactanți are efecte diferite asupra CMC:
compuși cu conținut scăzut de molecule (alcooli, acetonă) ↑ CMC (dacă nu există solubilizare)
compuși cu lanț lung ↓ CMC (stabilitatea micelilor crește).
3). Efectul temperaturii T.
Există un caracter diferit al influenței lui T asupra IRV și NIPAV.
O creștere a T pentru soluțiile IPA sporește mișcarea termică și previne agregarea moleculelor, dar mișcarea intensivă reduce hidratarea grupurilor polar și facilitează asocierea lor.
Mulți agenți tensioactivi cu R mare nu formează soluții miceliare din cauza solubilității scăzute. Totuși, atunci când T este variat, solubilitatea surfactantului poate crește și este detectată de către MCE.
T, cu pisica. solubilitatea IPA crește din cauza formării MC, se numește punctul Kraft (de obicei 283-293 K).
T. Krafta nu coincide cu TPL TV. Surfactant, dar se află mai jos, pentru că în gelul umflat, agentul tensioactiv este hidratat și acest lucru facilitează topirea.
Fig. 7.2. Diagrama de fază a unei soluții de surfactant coloidal în apropierea punctului Kraft
Pentru a obține un surfactant cu o valoare a punctului Kraft scăzut:
a) sunt adăugați suplimentari de CH3 sau substituenți laterali;
b) introduceți conexiunea nesaturată "=";
c) un segment polar (oxietilen) între grupul ionic și lanț.
Deasupra punctului K al RR, MC-ul IPAW se descompune în asociați mai mici - se produce demicelizarea.
(Formarea micelilor are loc într-un interval de temperatură definit pentru fiecare surfactant, cele mai importante caracteristici fiind punctul Kraft și punctul de nor.
Punctul lui Kraft este limita inferioară de temperatură a formării micelilor de surfactanți ionici, de obicei este egală cu 283 - 293K; la temperaturi sub punctul Kraft, solubilitatea surfactantului este insuficientă pentru a forma miceli.
Punctul de nori este limita de temperatură superioară a formării micelilor de surfactanți neionici, valorile uzuale ale acestora fiind de 323-333 K; la temperaturi mai mari, sistemul tensioactiv-solvent pierde stabilitatea și se stratifică în două macrofage.)
2) ↑ T în soluțiile NIPAV ↓ CMC datorită deshidratării lanțurilor de oxietilenă.
În soluțiile Nipah observate punct nor - limita superioară de temperatură MTSO Nipah (323-333 K), la sistemul T superior devine instabil și stratificat în două faze.
Termodinamica și mecanismul de formare a micelilor (MCE)
(Solubilitatea reală a agenților tensioactivi se datorează unei creșteri a entropiei S după dizolvare și, într-o măsură mai mică, a interacțiunii cu moleculele de apă.
Disocierea în apă este tipică pentru IPAV, iar dizolvarea lor este semnificativă.
NIPAV interacționează slab cu H20, solubilitatea lor fiind mai mică pentru același R. Mai des, ΔH> 0, prin urmare, solubilitatea ↑ pentru ↑ T.
Solubilitatea redusă a surfactantului se manifestă în activitatea suprafeței "+" și cu ↑ C - într-o asociere semnificativă a moleculelor de surfactant care trec în MCH. )
Luați în considerare mecanismul dizolvării agenților tensioactivi. Se compune din două etape: tranziția de fază și interacțiunea cu moleculele de solvenți - solvație (apă și hidratare):
ΔNf> 0 ΔSf.p> 0 ΔRating> 0 și solubilitatea ΔG. -3 mol / l), pornind de la CMC, care formează micelii strat difuz counterion înconjurat ionic, dependența = f () este rupt și se observă întreruperea liniei.
O altă metodă pentru determinarea CMC se bazează pe măsurarea tensiunii superficiale a soluțiilor apoase de agent tensioactiv, care scade cu creșterea concentrației până la CMC și apoi rămâne practic constantă. Această metodă este aplicabilă atât surfactanților ionici, cât și celor neionici. Pentru a determina CMC, datele experimentale privind dependența lui de C sunt reprezentate de obicei în coordonatele = f (lnC) (figura 7.3).
Izotermele σ = f (C) izotermelor diferă de la soluții adevărate surfactant mai clară ↑ ↓ σ C și prezența fracturii la concentrații scăzute (circa 10 -3-10 -6 mol / L), peste care rămâne constantă σ. Mai mult decât atât, acest punct al CMC este detectat pe izotermă σ = f ln (C) în conformitate cu
Diagrama dependenței indexului de refracție n de concentrația soluției de surfactant este o linie întreruptă de două segmente care se intersectează la punctul CMC (Figura 7.4). Din această dependență, este posibil să se determine CMC de surfactanți în medii apoase și neapoase.
În Recueil adevărată soluție (moleculară) a fost transferată într-o soluție coloidală, sporind astfel în mod dramatic sistemul de împrăștiere a luminii (se poate observa împrăștierea luminii de către particulele de praf în suspensie în aer). Pentru a determina CMC este măsurată prin difuzia luminii sistemului de densitate optică D în funcție de concentrația de surfactant (ris.7.5) LSP sunt generate de la D = f (C).
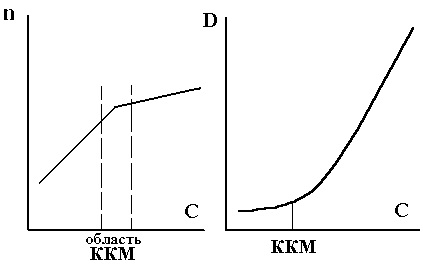
Fig. 7.4. Determinarea CMC prin metoda de măsurare a indicelui de refracție n.
Fig. 7.5. Determinarea metodei CMC prin metoda dispersiei luminii (dreapta).
Articole similare
-
Cercetarea în chimie - galben, roșu, verde - ceea ce este mai util 9 clasa
-
Conceptul de reacții chimice și clasificarea acestora - chimie
Trimiteți-le prietenilor: