PREZENTARI GENERALE DESPRE PLASARE
Procesul de formare a proteinelor constă în trei etape:
și se termină cu livrarea de proteine în locul funcționării sale viitoare. Pentru aceasta, există mecanisme speciale, iar soluția problemei începe chiar și cu traducerea.
Traducere - includerea secvențială a aminoacizilor în lanțurile peptidice în construcție, în conformitate cu secvența codon a ARNm
În procesul de traducere, participă 4 tipuri de ARNm, care se combină în nucleol cu proteine ribozomale, formând subunități ale ribozomilor. Aceste subunități trec prin porii nucleari în citoplasmă. Multe mRNA migrează, de asemenea, la complex cu proteine speciale și zeci de specii tRNA. Pe de altă parte, 20 de tipuri de aminoacizi sunt prezente în citoplasmă. sintetizat în celulă sau primit din sânge. De asemenea, există 20 de tipuri de enzime - aminoacil-tRNA-sintetază și factori suplimentari de proteine. Toate aceste substanțe sunt implicate în:
· Plierea - plierea lanțului peptidic într-o structură spațială
· Modificări - adăugarea componentelor carbohidraților, oxidarea anumitor reziduuri de aminoacizi etc.
La locul localizării finale în celulă, proteinele sunt împărțite în: export, membrană, lizozomală și internă.
Export - adică destinate izolării din celulă, proteinele membranare și lizozomale se formează prin ribozomi legați de membrană. Ie ribozomii atașați la suprafața membranelor reticulului endoplasmatic (EPS). Datorită acestui fapt, sfârșitul peptidei sintetizate pătrunde în spațiul interior al EPS, unde se produce apoi întreaga proteină. În același spațiu are loc plierea și modificarea proteinei. În continuare, în transport și modificare, alte structuri de membrană, în primul rând aparatul Golgi și, în cele din urmă, proteina
- sau este eliberat în timpul exocitoză din celulă,
- sau este inclus în compoziția unei membrane,
- sau rămâne în interiorul lizozomului format.
În contrast, proteinele interne (proteinele hialoplasmei, mitocondriile, nucleele etc.) sunt sintetizate pe proteine libere, adică ribozomi legați de membrană.
Există mai multe niveluri de structură a proteinelor: primar, secundar, terțiar, și pentru proteine oligomerice - și structura cuaternară.
Structura primară este o secvență de resturi de aminoacizi legate una de alta prin legături peptidice. Această structură este direct codificată de secvența codonică în mARN și reprodusă prin traducere.
Este de o importanță fundamentală faptul că practic toate cele 20 de resturi de aminoacizi găsite în proteinele naturale au un plan de structură similar. Acestea conțin un schelet cu trei membri, cu un atom de mediu (a-carbon) din care unul sau alt radical (R) este legat. Conectând cu fiecare alte legături peptidice, ele formează un nucleu continuu al lanțului de peptide. unde se alternează trei tipuri de conexiuni (Fig.1.1).
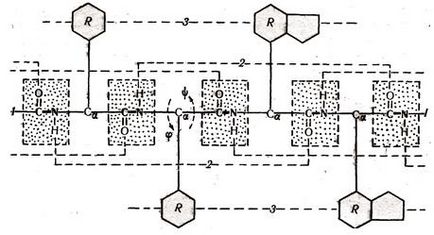
Fig. 1.1 Structura primară a proteinelor
În jurul uneia dintre ele - legătura peptidică-CO-NH-rotație este imposibilă. În jurul celeilalte două rotații sunt posibile rotirea a două grupări -NH-CaH- și -CaH-CO-. Aceasta permite lanțului peptidic să se flexeze, formând o structură secundară și terțiară.
Structura secundară. Inițial, multe fragmente din lanțul de peptide dobândesc un ambalaj periodic de un tip sau altul: structura a-helix sau b-structura. Acest tip de ambalaj se numește o structură secundară. În aceeași moleculă a proteinei globulare, pot apărea diferite tipuri de structură secundară și, de asemenea, situsuri non-structurale. Relația dintre ele este diferită (Tabelul 1.1).
În proteinele fibrilare, structura secundară este de obicei monotonă. Alfa spiralele sunt proteine - miozina, tropomyozina, alfa-keratina. În aceste proteine, mai multe lanțuri cu o helix alfa sunt răsucite într-o suprapusă. Proteine cu structură beta numai - fibrină de mătase și beta-keratină (formată din a-keratină atunci când este tratată cu abur fierbinte).
Tabelul 1.1. Distribuția resturilor de aminoacizi între cele trei
variante ale structurii secundare
Un tip special a structurii secundare a colagenului de proteine, care prezintă asemănări cu structuri alfa și beta numite colagen helix.
catena peptidică scheletul unui helix este răsucit în spirală, astfel încât amino radicalii sunt rotite spre exterior din elicea (figura 1.2).
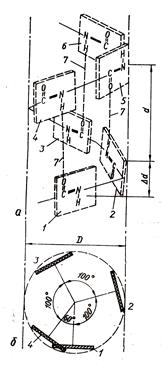
Fig. 1.2. Structura secundară a proteinelor. Alpha-Helix
Structura ținute împreună prin legături de hidrogen între schelete de aminoacizi, și în formarea unei astfel de legătură implică -NH-un grup de un aminoacid și -CO- - la altul, care se află în lanțul peptidic este separată de prima prin 3 alți aminoacizi. Ca rezultat, o medie de 3,6 reziduuri de aminoacizi pe o bobina de a-helix. Helixul alfa se formează numai pentru că este starea cea mai avantajoasă din punct de vedere termodinamic pentru o anumită regiune a lanțului de peptide.
b-structura - magistralelor de lanț peptidic nu sunt răsucite într-o spirală, și au o configurație în zig-zag (o structură foaie pliată din figura 1.3). Acesta este reținut de legături de hidrogen între aceleași grupuri, dar acum (în cazul unei proteine globulare), aceste grupuri converg și formează legături
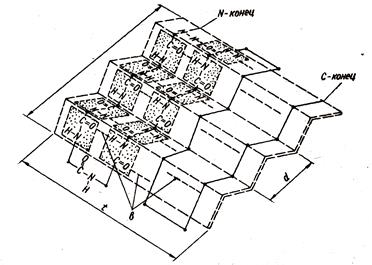
Fig. 1.3. Structura secundară a proteinelor. Structura beta
lanțul de peptide formează falduri de 2 tipuri - falduri mari care rezultă dintr-o întoarcere de lanț de 180 ° și coturi de lanț mici într-o singură pliere. Secțiunile adiacente ale lanțului din structura b pot fi paralele sau antiparalerale (figurile 1.4 și 1.5).
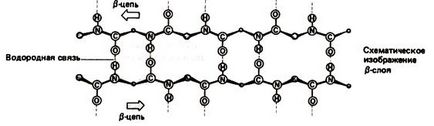
Fig. 1.4. Succes de lanț antiparalel în structura b
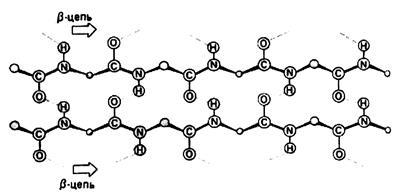
Fig.1. 5. Secțiuni paralele ale lanțului în structura b
În proteinele fibrilare cu b-helix, lanțurile de peptide învecinate și paralele participă la formarea legăturilor de hidrogen.
Structura secundară a unei proteine sau a fragmentului acesteia este determinată de structura sa primară.
Grupările laterale de aminoacizi, deși nu participă la stabilizarea structurii legăturilor, dar se determină modul în care catena peptidică poate plia pentru a forma astfel de obligațiuni și dacă buclat deloc. De exemplu, reziduurile de prolină și hidroxiprolină exclud în totalitate formarea atît a-helix, cît și a structurii b în locusul lor. În același timp, radicalii încărcați de aminoacizi nu se pot apropia de a-helix datorită repulsiei reciproce etc.
Structura terțiară. Structura terțiară se spune că se aplică numai proteinelor globulare. Prin aceasta se înțelege conformarea globulei proteice, adică în spațiul secțiunilor a-elicoidale, b-structurale și fără structură ale lanțului de peptide. Spre deosebire de secundar, structura terțiară este formată și reținută prin formarea legăturilor direct între radicalii de aminoacizi. Natura obligațiunilor depinde de natura radicalilor (Tabelul 1.2).
Tabelul 1.2 Tipuri de radicali de aminoacizi și legăturile pe care le formează
Inclusiv: 28 hidrofobe și 65 hidrofile
După cum se poate observa din datele din tabel. 1.3, marea parte hidrofobă radicalii este în Globula (unde se depărteze de faza apoasă) și radicalii mai hidrofile - pe suprafața sa. În același timp, această regulă nu este absolută: unii radicali hidrofobi rămân la suprafață.
Acesta din urmă este foarte important pentru interacțiunea proteinei cu liganzii care au grupări hidrofobe.
Formarea structurii terțiare joacă un rol decisiv în obținerea de proteine a activității sale funcționale inerente. De regulă, la nivelul acestei structuri, în proteină apare o așa-zisă proteină. centrele active (unul sau mai multe) - grupuri de mai mulți radicali, capabili să interacționeze în mod specific cu anumiți liganzi.
Acești radicali la nivelul structurii primare sunt adesea departe unul de celălalt și converg doar în procesul de pliere.
Cu toate acestea, structura terțiară are o anumită mobilitate. Conformarea globulei poate fi afectată de următorii factori:
- fluctuațiile termice și vibrațiile grupurilor individuale, atunci când legăturile dintre ele sunt rupte, se închid din nou;
- modificarea chimică a proteinei (de exemplu, fosforilarea);
- îndeplinirea foarte bună a proteinei prin funcția sa.
Schimbarea conformării proteinelor este cel mai important mod de a-și schimba activitatea biologică, care este utilizat pe scară largă în celulă pentru reglarea diferitelor procese.
Structura cuaternară. Conceptul de structură cuaternară este aplicabil numai proteinelor constând din mai multe subunități. (de exemplu, hemoglobina este formată din 4 subunități din 2 specii). Structura cuaternară are aproximativ 5% proteine, incluzând hemoglobina, imunoglobulina, insulina. Aproape toate polimerazele ADN și ARN au o structură cuaternară. Legăturile care formează și susțin structura cuaternară sunt aceleași ca și în formarea structurii terțiare, cu excepția hidrofobiei.
Subunitățile sunt legate de interacțiunea radicalilor de aminoacizi localizați pe suprafețele de contact ale subunităților. Aceste suprafețe sunt reciproc complementare în funcție de aranjamentul radicalilor. În special, ele sunt adesea îmbogățite cu radicali hidrofobi și încărcați heterogen. Astfel, legarea subunităților poate avea loc numai după formarea unei structuri terțiare. Iar această legare însăși afectează structura terțiară care o aduce la proteine active sau inactive active. Prin urmare, astfel de proteine sunt, de obicei, active numai în forma oligomerică (hemoglobină) sau invers doar în starea disociată (protein kinaza). În acest caz, unele subunități servesc la suprimarea activității altora și la disociere sub influența unui semnal special (cAMP).
Articole similare
Trimiteți-le prietenilor: