Din ecuația lui Gibbs rezultă că caracteristica comportamentului unei substanțe în timpul adsorbției este magnitudinea derivatului. dar valoarea sa se modifică odată cu schimbarea concentrației (a se vedea figura 3.2). Pentru a da această valoare forma constantei caracteristice, luați valoarea limită (pentru c 0). Această valoare PA Rebinder (1924) a numit activitatea de suprafață g:
Cu cât tensiunea superioară scade cu concentrația substanței adsorbite, cu atât este mai mare activitatea de suprafață a acestei substanțe și cu atât mai mult este adsorbția Gibbs.
Activitatea suprafeței poate fi determinată grafic ca o tangență negativă a unghiului tangent, trasă la curba = f (c) în punctul de intersecție cu axa de coordonate.
Astfel, pentru agenții tensioactivi: g> 0; <0, Гi> 0. Pentru IRP: g <0;> 0, Γι <0.
Au fost stabilite următoarele.
1. Activitatea de suprafață (g) crește odată cu scăderea polarității substanței. Prin urmare, activitatea de suprafață a acizilor organici este mai mare decât g pentru sărurile lor, de exemplu:
Acest lucru explică de asemenea inactivitatea zaharzei, a cărei moleculă, împreună cu scheletul de hidrocarburi nepolar, are multe grupuri polar, astfel încât molecula are un echilibru între părțile polar și nepolar.
2. În seria omoloagă, există modificări ale activității suprafeței (g): crește cu creșterea lungimii radicalului hidrocarbonat.
Bazat pe un material experimental mare la sfârșitul secolului al XIX-lea. Duclos și Traube au formulat regula:
Activitatea de suprafață a acizilor grași în soluții apoase crește cu un factor de 3,5 până la 3,5 atunci când lanțul de hidrocarburi este extins cu o legătură (grupa -CH2).
În Fig. Figura 3.4 prezintă izotermele de tensiune de suprafață pentru un număr de acizi.
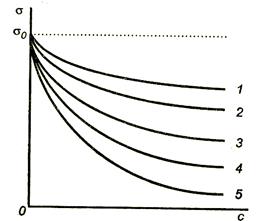
Figura 3.4. Izoterma tensiunii superficiale a anumitor acizi
Astfel, g1 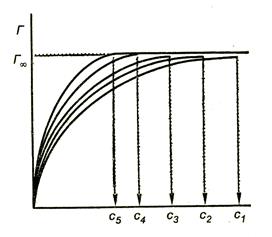
Figura 3.4. Izotermia adsorbției de acid
Analiza izotermelor de adsorbție relevă următoarele reguli:
Faptul că Gi ipsos (în toate cazurile, are tendința de a. Fi explicat ca monomolecular de adsorbție. Dar cum putem explica faptul că absorbția maximă în cadrul unei serii omoloage nu depinde de radicalul lungimea hidrocarburii? Poate doar un aranjament strict definit de molecule în stratul de suprafață.
Articole similare
Trimiteți-le prietenilor: