În natură, cel mai adesea există amestecuri de substanțe diferite. Amestecurile diferitelor substanțe în diferite stări agregate pot forma sisteme eterogene și omogene. Astfel de sisteme vor fi numite dispersive.
Dispersa este un sistem alcătuit din două sau mai multe substanțe, dintre care unul, sub formă de particule foarte mici, este distribuit uniform în volumul celuilalt.
Substanța se rupe în ioni, molecule, atomi, înseamnă "zdrobită" în cele mai mici particule. "Zdrobire"> dispersie, adică substanțele sunt dispersate la dimensiuni diferite de particule vizibile și invizibile.
O substanță care este prezentă într-o cantitate mai mică, se dispersează și este distribuită în volumul celeilalte, se numește o fază dispersată. Acesta poate consta din mai multe substanțe.
O substanță prezentă într-o cantitate mai mare, în volumul căruia este distribuită faza dispersată, se numește un mediu dispersat. Între ea și particulele fazei dispersate, există o suprafață de separare, astfel încât sistemele de dispersie sunt numite eterogene (neomogene).
Atât mediul dispersat cât și faza dispersată pot fi reprezentate de substanțe în diferite stări agregate - solide, lichide și gazoase.
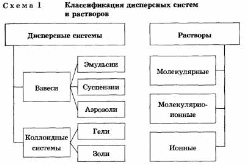
Întrebarea. Emulsiile. Suspendarea. Soluții coloidale
Emulzia este o dispersie de particule microscopice de un lichid în altul. Emulsiile pot fi formate din două lichide nemiscibile. În majoritatea cazurilor, una dintre fazele emulsiilor este apa. Emulsiile tip ulei-în-apă (M / B) sunt emulsii în care faza continuă este apă, iar faza dispersată este un lichid "uleios" insolubil în ulei. Emulsiile apă-în-ulei (W / M) sunt emulsii în care faza continuă este uleiul și faza dispersată este apă. Emulsiile pot avea mai mult de două faze. În astfel de emulsii, particulele dispersate însele conțin chiar și particule mai mici din cea de-a treia fază (de obicei același lichid ca în faza continuă). Emulsia, care este formată prin amestecarea uleiului și a apei, se descompune rapid atunci când acest proces este oprit. Pentru stabilizarea sistemului, o componentă terță (emulgator) este introdusă în emulsie, care previne sau încetinește separarea fazelor. Emulsiile de bitum sunt de obicei emulsii de tip M / B. Cu toate acestea, emulsiile inversate (inversate) obținute pe bitum lichefiat au, de asemenea, propriul lor domeniu de aplicare special. Există dovezi că emulsiile cu mai multe faze ale tipului V / M / B pot fi formate din bitum. Emulsiile, care conțin 40 până la 80% bitum, reprezintă un lichid maro. Consistența acestui lichid este "de la lapte la cremă groasă". Dimensiunea particulelor (în diametru) este de obicei de la 0,1 la 20 microni.
Suspensia este un amestec de substanțe în care solidul este distribuit sub formă de particule mici într-o substanță lichidă într-o stare suspendată. Suspensia este un sistem dispersat grosier cu o fază dispersată solid și un mediu de dispersie lichid. În mod obișnuit, particulele fazei dispersate sunt atât de mari (mai mult de 10 microni) încât se găsesc sub acțiunea gravitației (sediment). Suspensiile în care sedimentarea este foarte lentă, datorită unei mici diferențe în densitatea fazei dispersate și a mediului de dispersie, sunt uneori numite suspensii. În suspensii dispersate se formează ușor structuri dispersate. Suspensiile tipice sunt pulpa, nămoluri de foraj, mortare de ciment, vopsele de smalț. Utilizată pe scară largă în producția de ceramică.
Soluțiile coloidale sunt sisteme cu două faze înalt dispersate, constând dintr-un mediu de dispersie și o fază dispersată, dimensiunile liniare ale acestora din urmă fiind în intervalul de la 1 la 100 nm. După cum se poate observa, soluțiile coloidale în dimensiunile particulelor sunt intermediare între soluțiile și suspensiile reale și emulsii. Particulele coloidale constau, de obicei, dintr-un număr mare de molecule sau ioni. Soluțiile coloidale sunt numite și soluri. Ele sunt obținute prin metode de dispersie și de condensare. Dispersarea se face cel mai adesea cu ajutorul unor "mori coloidale" speciale. În metoda de condensare, particulele coloidale se formează prin combinarea atomilor sau a moleculelor în agregate. Atunci când au loc multe reacții chimice, se produce condens și se formează sisteme de dispersie înaltă. Spre deosebire de soluțiile reale pentru soluri, efectul Tin Dal este caracteristic, adică împrăștierea luminii de particule coloidale. Când un fascicul de lumină trece prin sol, în camera întunecată apare un con de lumină. Deci, puteți recunoaște dacă soluția este coloidală sau adevărată. Una dintre proprietățile importante ale solurilor este că particulele lor au încărcături electrice de același semn. Din acest motiv, nu se combină în particule mai mari și nu se așează. În acest caz, particulele unor soluri, de exemplu, metale, sulfuri, acizi siliciici și tinici, au o sarcină negativă, alții, de exemplu, hidroxizi, oxizi metalici, - o încărcătură pozitivă. Apariția încărcării se explică prin adsorbția ionilor din soluție prin particule coloidale. Pentru a precipita solul, este necesar ca solidele acestuia să fie conectate la agregate mai mari. Combinația de particule în agregate mai mari se numește coagulare, iar sedimentarea prin particule sub influența gravitației este sedimentarea. De obicei, coagularea apare când se adaugă solului: 1) un electrolit, 2) un alt sol al cărui particule are încărcătura opusă și 3) când este încălzit.
Articole similare
-
Răspunsuri la cele mai frecvente întrebări despre ved, acreditive și transport
-
Întrebări coordonator de nunți pe care ezitați să le întrebați
Trimiteți-le prietenilor: