Apă pentru injecție
Notă:
1. Titru al virusului nominal.
Aceasta corespunde cu titrul minim garantat de către producătorul de la data la data de expirare. Pentru a compensa scăderea titrului virusului în timpul duratei de viață viabile a preparatului administrat în exces: la momentul eliberării dozei vaccinării medicamentului 1 conține cel puțin 3,5 Ig TCD50 virusul viu rujeolic atenuat (tulpina Schwarz), cel puțin 4,3 Ig TCD50 virusul viu atenuat oreionului (RIT 4355 tulpina) de cel puțin 3,5 Ig TCD50 virusul viu atenuat rubeolei (Wistar RA 27/3 tulpina)
2. TCC50 - o doză citopatogenică țesut care provoacă moartea a 50% din celulele monostrat.
DESCRIERE
Liofilizat: masă poroasă omogenă de culoare albă până la roz deschis.
Solvent: lichid limpede, incolor, inodor, fără impurități vizibile.
Soluție reconstituită a medicamentului: lichid limpede de la roz-portocaliu la roz; incluziunile mecanice vizibile ar trebui să fie absente.
CARACTERISTICILE PREPARATULUI
Prioriks® - combinate formulare liofilizată de vaccin tulpini atenuate ale virusului rujeolei (Schwarz), oreionului (RIT 4385 derivat Jeryl Lynn) si rubeolei (Wistar RA 27/3), cultivate separat într-o cultură de celule embrionare de pui (pojarului și oreionului virusuri) și diploid celulele umane (virusul rubeolei).
Priority® îndeplinește cerințele Organizației Mondiale a Sănătății pentru producerea de produse biologice, cerințe pentru vaccinurile rujeolei, oreionului, rubeolei și combinațiilor vii.
PROPRIETĂȚI IMUNOLOGICE
Studiile clinice ale vaccinului Priori® au arătat o eficacitate ridicată a medicamentului. Anticorpii la virusul rujeolic au fost detectați la 98%, la virusul oreionului la 96,1% și la virusul rubeolei la 99,3% din cei vaccinați. La un an după vaccinare, toate persoanele seropozitive au păstrat un titru protector de anticorpi față de virusul rujeolei și virusul rubeolei și 88,4% din virusul oreionului.
Un anumit grad de protecție împotriva bolii rujeolei poate fi obținut prin administrarea vaccinului persoanelor indigene în 72 de ore de la contactul cu rujeola.
INDICAȚII PENTRU UTILIZARE
Prevenirea rujeolei, a oreionului și a rubeolei de la vârsta de 12 luni.
CONTRAINDICAȚII
- Simptome ale unei reacții alergice după introducerea vaccinurilor pentru prevenirea rujeolei, oreionului și / sau rubeolei în istorie;
- hipersensibilitate la neomicină, orice alt ingredient al vaccinului și ouă de pui; În același timp, prezența în antecedente a dermatitei de contact cauzată de neomicină și a unei reacții alergice la ouăle de pui care nu sunt anafilactice nu este o contraindicație pentru vaccinare;
- imunodeficiențe primare și secundare. Notă: medicamentul poate fi administrat persoanelor cu infecție asimptomatică HIV, precum și pacienți cu SIDA;
- Sarcina;
- Vaccinarea este amânată până la sfârșitul manifestărilor acute ale bolii și exacerbării bolilor cronice. Cu ARVI ușoară, bolile intestinale acute și alte vaccinări au permis efectuarea imediat după normalizarea temperaturii.
APLICAREA SĂNĂTĂȚII ȘI PERIOADA DE ÎNCĂLZIRE A PĂRII
sarcină
Femeile gravide nu trebuie vaccinate cu Priori®.
În același timp, când se utilizează vaccinuri pentru prevenirea rujeolei, oreionului sau rubeolei la femeile gravide, deteriorarea fătului nu este documentată.
Chiar și în cazurile în care este imposibil să se excludă riscul teoretic, nu a fost un singur caz de sindrom rubeolei congenitale in randul 3500 de femei care, în timpul vaccin preparate care conțin componente rubeola, au fost în primele etape ale sarcinii, iar ei nu au știut despre sarcina. vaccinarea neprevăzută femeilor neinformat despre sarcină a urmat, medicamentele care conțin rujeolei, oreionului și componente rubeola nu este o indicație pentru întreruperea sarcinii.
Nu permiteți sarcina în decurs de o lună după vaccinare. Femeile care planifică o sarcină trebuie sfătuite să amâne debutul sarcinii.
Perioada de alăptare
Nu există date privind utilizarea femeilor care alăptează. Femeile care alăptează pot fi vaccinate dacă beneficiile vaccinării predomină asupra riscului posibil.
METODA DE UTILIZARE ȘI DOSE
Metodă de administrare
Priori® se administrează subcutanat, este permisă administrarea intramusculară a medicamentului.
Priori® nu poate fi administrat intravascular.
Solventul și preparatul reconstituit trebuie inspectate vizual înainte de utilizare pentru absența incluziunilor mecanice și / sau a modificării aspectului. Dacă acestea sunt detectate, utilizarea unui solvent sau a unui medicament reconstituit ar trebui eliminată.
Medicamentul reconstituit este un lichid limpede de la roz-portocaliu la roz, fără incluziuni vizibile.
Vaccinul Preorix nu trebuie amestecat în aceeași seringă cu alte vaccinuri.
Imediat înainte de utilizare, conținutul seringii sau fiolei furnizate cu un solvent la o doză de 0,5 ml pe o doză se adaugă la flacon cu preparatul.
Pentru administrarea medicamentului trebuie utilizat un ac steril nou.
Prepararea vaccinului înainte de administrare cu utilizarea unui solvent într-o fiolă
Vaccinul Priori® trebuie restabilit prin adăugarea volumului total de solvent din fiolă în flaconul care conține liofilizatul. După adăugarea solventului în liofilizat, agitați bine amestecul rezultat până când liofilizatul este complet dizolvat în solvent (nu mai mult de 1 minut). După restaurare, vaccinul trebuie introdus prompt. Pentru administrarea vaccinului trebuie utilizat un ac nou. Pentru introducere, tot conținutul este eliminat din flaconul vaccinului reconstituit.
Prepararea vaccinului înainte de administrare cu utilizarea unui solvent într-o seringă
Vaccinul Priori® trebuie restabilit prin adăugarea întregului volum de solvent din seringa preumplută la flaconul care conține liofilizatul.
Atenție vă rog! Ambalarea vaccinului Priori® poate fi reprezentată de două tipuri de seringi care diferă în modul în care acul este conectat la duza seringii.
Pentru a selecta metoda corectă de conectare a acului și a seringii, urmați instrucțiunile de mai jos:
Seringa de tip 1
Figura 1.
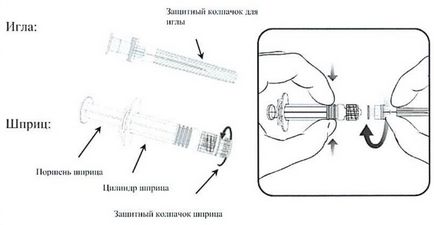
Instrucțiuni pentru prepararea unei seringi de tip 1 (figura 1) pentru utilizare:
1. Deșurubați capacul de protecție al seringii rotind-o în sens invers acelor de ceasornic (în timp ce țineți seringa de la cilindru, evitând contactul cu pistonul seringii).
2. Rotiți în sensul acelor de ceasornic pentru a conecta acul la seringă până când simțiți că se fixează în loc (vezi Figura 1).
3. Scoateți capacul de protecție de pe ac (în unele cazuri poate fi atașat strâns la ac).
Tipul seringii 2
În cazul în care pachetul conține o altă seringă decât cea prezentată în figura 1, după îndepărtarea capacului de protecție din duza seringii, așezați acul pe seringă până când se oprește, fără înșurubare suplimentară. Se adaugă solventul la liofilizator. După adăugarea solventului la liofilizat, amestecul rezultat trebuie agitat bine până când liofilizatul este complet dizolvat în solvent (nu mai mult de 1 minut). După restaurare, vaccinul trebuie introdus prompt. Pentru administrarea vaccinului trebuie utilizat un ac nou. Pentru introducere, tot conținutul este eliminat din flaconul vaccinului reconstituit.
Vaccinul reconstituit este utilizat imediat și nu este supus la depozitare.
Prelucrarea nefolosită și deșeurile rezultate din utilizarea acesteia trebuie distruse în conformitate cu cerințele adoptate în Federația Rusă.
Planuri de vaccinare
Doza de vaccin este de 0,5 ml.
În conformitate cu Calendarul inoculărilor preventive din Rusia, Priori® se administrează copiilor în vârstă de 12 luni urmată de vaccinarea de rapel la vârsta de 6 ani.
Priori® poate fi administrat fetelor la vârsta de 13 ani care nu au fost vaccinate sau care au primit doar un vaccin cu vaccinuri monovalente sau combinate împotriva rujeolei, rubeolei și oreionului.
EFECTE ADVERSE
SUPRADOZĂ
În timpul observării după înregistrare au fost raportate cazuri de supradozaj (depășirea dozei recomandate de cel mult 2 ori). Nu au existat reacții adverse datorate supradozajului.
INTERACȚIUNEA CU ALTE PREPARATE
Prioriks® pot fi administrate simultan (într-o zi) și vaccinurile DTP DT, vaccin poliomielitic viu și inactivat, un vaccin împotriva H. influenzae tip b, vaccin hepatitic B Preparatele injectabile furnizate seringi separate la diferite site-uri. Alte vaccinuri virale vii sunt administrate la intervale de cel puțin 1 lună.
Priori® nu este permis să fie amestecat cu alte vaccinuri din aceeași seringă.
Vaccinul Priori® poate fi utilizat pentru a reactiva indivizii vaccinați anterior cu un alt vaccin combinat împotriva rujeolei, oreionului și rubeolei sau cu preparate mono adecvate.
Dacă este necesar un test de tuberculină, trebuie efectuat înainte sau în același timp cu vaccinarea, deoarece vaccinurile vii împotriva rujeolei (și, eventual, oreionul) pot determina o scădere temporară a sensibilității pielii la tuberculină. Datorită faptului că o astfel de scădere a sensibilității poate dura între 4 și 6 săptămâni, diagnosticarea tuberculinei nu trebuie efectuată în intervalul de timp specificat după vaccinare, pentru a evita rezultatele fals negative.
Pacienții tratați anterior cu produse din sânge uman (imunoglobuline, plasma și altele), vaccinarea trebuie amânată pentru cel puțin trei luni, din cauza probabilitatea formării insuficiente a anticorpilor la oreion, pojar și rubeolei.
INSTRUCȚIUNI SPECIALE
Trebuie să se acorde atenție administrării vaccinului persoanelor cu boli alergice și convulsii într-un istoric personal și familial.
Ca și în cazul utilizării altor produse biologice, datorită posibilității de a dezvolta o reacție alergică de tip imediat, vaccinatul trebuie monitorizat timp de cel puțin 30 de minute. Camerele de altoire ar trebui să fie prevăzute cu terapie anti-șoc, inclusiv o soluție de adrenalină de 1: 1000.
După vaccinare sau uneori în fața acestuia, leșinul sau slăbiciunea severă sunt posibile ca o reacție psihologică la injectare. Înainte de vaccinare este important să vă asigurați că pacientul nu se rănește în cazul unei sincopă.
Vaccinarea femeilor în vârstă fertilă se efectuează în absența sarcinii și numai dacă femeia acceptă să fie protejată de concepție în decurs de o lună după vaccinare.
Ca și în cazul oricărei alte vaccinări, nu toți vaccineenii pot avea un răspuns imun protector.
La copiii sub vârsta de 12 luni, răspunsul imun protector la componenta pojar a vaccinului poate fi insuficientă datorită posibilei persistența anticorpilor maternali y-le la virusul rujeolei. Cu toate acestea, nu ar trebui să fie un motiv pentru a exclude aplicarea Prioriks® vaccin la sugari (după vaccinarea primară la pacienții cu trombocitopenie au fost documentate cazuri de re-exacerbare a manifestărilor de boală și, în acest context, decizia cu privire la atribuirea vaccinului la acești pacienți ar trebui Prioriks® se ia în mod individual, luând în considerare evaluarea riscurilor și beneficiilor și numai după consultarea medicului specialist.
Datele privind utilizarea Prioriks® droguri la persoanele cu sistemul imunitar compromis sunt limitate, astfel vaccinarea trebuie efectuată cu precauție și numai atunci când, în opinia medicului, beneficiul depaseste riscul (de exemplu, cei cu infectie asimptomatica cu HIV).
La persoanele cu un sistem imunitar compromis, care nu sunt vaccinate contraindicata (a se vedea „Contraindicații“), precum și la pacienții imunocompetenți nu pot dezvolta un răspuns imun adecvat, unii dintre cei vaccinați, respectiv, pot fi infectate cu rujeolă, oreion sau rubeolă, în ciuda vaccinării corecte. Persoanele cu condiții de imunodeficiență trebuie monitorizate cu atenție pentru semne de rujeolă, oreion și rubeolă.
Transmiterea virusului rujeolic și oreionului de la persoanele vaccinate la contactele nevaccinate nu a fost înregistrată. Există cazuri de descărcare faringiană a virusului rubeolei la 7-28 zile după vaccinare, cu un vârf de eliberare la aproximativ ziua a 11-a. Cu toate acestea, nu există dovezi care să susțină transmiterea virusului vaccinului eliberat persoanelor de contact nevaccinate.
Înainte de administrarea vaccinului trebuie să se asigure că alcoolul sau alt dezinfectant sa evaporat de la suprafața pielii și dopul flaconului, deoarece aceste substanțe pot inactiva virusurile din compoziția de vaccin atenuat.
FORMULAR DE RĂSPUNS
Liofilizat pentru prepararea soluției pentru injecție subcutanată și intramusculară, 1 doză (0,5 ml).
liofilizat
În conformitate cu un flacon de vaccin realizat din sticlă tip I transparent (Eur. F.) cu dopuri de cauciuc din cauciuc și un capac de aluminiu la run-prevăzut cu un capac de plastic protector.
solvent
Pentru 0,5 ml într-un flacon din sticlă transparentă de tip I (ebraică F.).
Pentru 0,5 ml într-o seringă din sticlă transparentă de tip I (ebraică F.). Duză de seringă este etanșată ermetic cu un capac de protecție din cauciuc sau sigilat cu un dop de cauciuc etanș, cu capac de protecție cu șurub.
deplinătate
1 flacon cu liofilizat, 1 fiolă cu solvent în blister, închis cu un film. Pentru 1 blister cu instrucțiuni de utilizare într-un pachet de carton.
1 flacon cu liofilizat, 1 seringă cu solvent furnizat acul 1 într-un recipient de plastic separat, cu o canulă, închis cu un capac de plastic într-un ambalaj blister, un film închis. 1 blister cu instrucțiuni de utilizare într-un carton.
1 sticlă cu liofilizată. 1 seringă cu solvent complet, cu 2 ace în recipiente de plastic separate cu canulă, capace din plastic închis, într-un blister, acoperit cu un film. Pentru 1 blister cu instrucțiuni de utilizare într-un pachet de carton.
100 de flacoane cu liofilizat cu instrucțiuni de utilizare într-o cutie de carton. Solvent separat: 100 fiole într-o cutie de carton.
SFATUL VIEȚII
Liofilizat: 2 ani.
Solvent: 5 ani.
Termenul de valabilitate al kitului este indicat de cel mai scurt termen de valabilitate al uneia dintre componente.
Nu utilizați după data de expirare înscrisă pe ambalaj.
Data expirării este ultima zi a lunii indicate pe ambalaj.
CONDIȚII DE STOCARE
liofilizat
A se păstra la o temperatură de 2 până la 8 ° C. Nu îngheța.
Păstrați într-un loc întunecat.
solvent
A se păstra la o temperatură de 2 până la 25 ° C. Nu îngheța.
Kit (liofilizat, solvent, cu ace sau fără ace)
A se păstra la o temperatură de 2 până la 8 ° C. Nu îngheța.
Păstrați într-un loc întunecat.
A nu se lăsa la îndemâna copiilor.
CONDIȚIILE DE TRANSPORT
liofilizat
Transportul la o temperatură de 2 până la 8 ° C Nu îngheța.
solvent
Transportul la o temperatură de 2 până la 28 ° C Nu îngheța.
Kit (liofilizat, solvent, cu ace sau fără ace)
Transportul la o temperatură de 2 până la 8 ° C Nu îngheța.
CONDIȚII DE VACANȚĂ
Ambalaj care conține 1 flacon de liofilizat și 1 fiolă sau o seringă cu solvent de prescripție medicală.
Ambalaj conținând 100 flacoane cu liofilizat, un ambalaj conținând 100 de fiole cu un solvent - pentru tratamente și instituții profilactice.
PRODUCĂTOR
Producător de forme de dozare gata
"GlaxoSmithKline Bayolodikalz SA", Belgia
"Phidia Pharmaceuticals SpA, Italia"
Ambalaj (ambalare primară)
"GlaxoSmithKline Bayolodikalz SA", Belgia
"Phidia Pharmaceuticals SpA, Italia"
Ambalaj (ambalaj secundar (pentru consumatori)
"GlaxoSmithKline Bayolodikalz SA", Belgia
"SmithKline Beecham-Biomed" SRL, Rusia
Eliberarea controlului calității
GlaxoSmithKline Bayolodikalz s.a. / GlaxoSmithKline Biologicals s.a.
Rue de l'Enstitou, 89, 1330 Rixensart, Belgia / Rue de l'Institut, 89, 1330 Rixensart, Belgia
LLC "SmithKline Beecham-Biomed"
143422, Rusia, regiunea Moscova Krasnogorskiy rn, cu. Petrov-Dalnee, le "Biomed". Mechnikov
FarmGruppa:
Articole similare
Trimiteți-le prietenilor: