Prin electroliți se înțelege sărurile, acizii, bazele, care într-o soluție de apă se descompun într-un grad mai mare sau mai puțin (disociază) în ioni mobili liberi.
Sodiul și clorul, de exemplu, se găsesc în cristalul unei sări obișnuite, de asemenea sub formă de ioni, dar legate de o rețea de ioni. În timpul dizolvării, devine mobilă datorită disocierii, iar structura zăcământului este ruptă de moleculele de apă.
Ioni sunt particule încărcate electric care, atunci când disociază electroliții, devin mobile într-o soluție apoasă, sunt blocate de moleculele de apă.
Adăugăm, de exemplu, clorură de sodiu în apă - ionii de sodiu și clor vor deveni mobili. În domeniul curentului direct (Figura 3), particulele încărcate pozitiv deplasează catodul (cationii), încărcat negativ - la anod (anioni).
Valence corespunde valorii unei taxe pozitive sau negative.
Principalele cationi din organism:
mEq / L = g / dl X 1,04 (pH 5,08)
După introducerea unităților SI, concentrațiile de cationi și anioni vor fi notate în mmol / l (1 mmol = greutate moleculară sau atomică relativă în mg). Pentru ionii unici încărcați (de exemplu, Na +, K +), valorile nu se modifică (1 mmol = 1 meq); pentru ionii multivalenți aceștia vor fi diferiți (Ca2 +: 1 mmol = 2 meq).
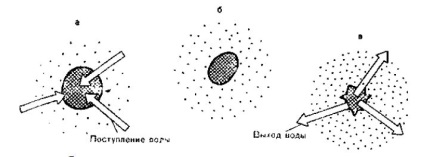
Fig. 5. Schimbarea volumului de eritrocite în funcție de presiunea osmotică a soluțiilor de clorură de sodiu de diferite concentrații.
a - soluție hipotonică de clorură de sodiu: umflarea eritrocitelor până la rupere (hemoliză);
b - soluție izotonică de clorură de sodiu; c - soluție de clorură de sodiu hipertonică;
ondularea eritrocitelor (forma unui măr încrețit).
Osmolalitatea înseamnă un număr osmotic pe 1 kg de solvent, osmolalitate - pentru 1 litru de soluție.
Presiunea osmotică a soluției depinde de numărul de particule active osmotic (ioni și molecule nedisociate) care se află într-un anumit volum.
Unitatea de presiune osmotică este Osmol sau Massmol (milliosmol). Dacă 1 mol de glucoză (masa moleculară relativă 180,2, 1 mol = 180,2 g) este de 1 kg de apă, această soluție are osmolalitatea „ideal“ egal cu 1 osmmol. Dacă se adaugă la 1 kg de apă de 1 mol de sare (masa moleculară relativă = 58,4; 1 mol = 58,4 g), apoi un „ideal“ 2 osmmol osmolalitate, deoarece sarea se descompune în ioni de sodiu și clor, ca urmare a faptului că un număr dublu de particule apare în soluție, spre deosebire de glucoză. Soluțiile care conțin săruri complet disociați, presiunea osmotică poate fi determinată din simplistă numărul de cationi și anioni (așa-numitele osmolalitate ideale). În același timp, desigur, neglijează interacțiunea ion-ion, care afectează osmolalitatea și conduce la o osmolalitate „reală“.
Ratele osmotice sunt responsabile pentru distribuția apei, în diferite spații fluide din ortanism (Figura 5, a se vedea și punctul 1.4.3).
Presiunea osmotică este determinată prin măsurarea scăderii punctului de congelare (osmometrie).
Osmolalitatea în plasmă este de 290 mOsmol (kg de apă 38 ° C), (Geigy).
Plasma este compusă în principal din electroliți disociabile, sodiul la calcularea aproximativă a jumătății de plasmă definește osmolalitate. Efectul non-electroliți în stare normală ușor: glucoză: 100 mg / dl = 5,5 mosmmol plasma / litru (Geigy) uree: osmolaritate 100 mg / dl = 17,2 mosmmol plasmatic / litru (Geigy) plasmă poate fi calculată pe baza acestor reprezentări, dacă cantitatea de sodiu, uree și glucoză este cunoscută (Mansberger și colab.):
Diferențele dintre osmolalitatea calculată și măsurată demonstrează prezența substanțelor dizolvate necunoscute (toxinele?) Și servesc ca indicații pentru hemodializă (Mans-berger et al.).
Osmolalitatea scăzută se observă numai în cazul hiponatremiei; hiperosmolalitatea, dimpotrivă, este multivaluată (Mansberger și colab., hipernatremie, hiperglicozemie, uremie, substanțe necunoscute, o combinație a multor factori).
Din punct de vedere practic, se poate deduce din discuția de mai sus că concentrația de sodiu în plasmă determină osmolalitatea sa. Abaterile sunt observate, în special, cu diabetul, uremia și în prezența substanțelor necunoscute dizolvate. În acest sens, este necesară o măsurare exactă a osmolalității în fiecare caz în parte.
Presiune osmotică eficientă
Membranele semipermeabile sunt utilizate pentru a determina anomalii ale presiunii osmotice. Substanțele care trec parțial prin membranele celulare, de exemplu uree, determină o presiune osmotică să se abată numai în cantități care interferează cu permeabilitatea membranelor celulare. Astfel, presiunea osmotică eficientă este produsă numai de ioni adevărați.
Osmolalitatea plasmatică normală (290 mOsmol / kg apă) este punctul de plecare pentru tonicitate.
Soluțiile izotonice sunt (aproximativ):
-1 / 6 soluții moleculare de săruri, moleculele cărora disociază complet
pentru 2 ioni, de exemplu 1/6 soluție molară de sare de masă;
- 1/3 soluții molare, în cazul în care substanța de dizolvare nu disociază, de exemplu 1/3 soluție de glucoză molară.
Soluțiile care prezintă o osmolalitate mai mică comparativ cu plasma sunt hipotonice; Soluțiile care au o osmolalitate mai mare sunt hipertonice.
Osmolalitatea celulei corespunde cu cea a plasmei [Black, Moore, Burck, 1962]. Ar trebui să se ia în considerare faptul că o parte din electroliți din celulă rămâne nedisociată. Presiunea osmotică din celulă este în mod constant afectată de metabolism: atunci când compușii moleculați mari se dezintegrează într-un anumit număr de particule mai mici, osmolalitatea crește și în timpul sintezei scade.
Presiunea osmotică coloidală corespunde gradului de participare a proteinelor la osmolalitate.
Deoarece moleculele de proteine sunt foarte mari, numărul de particule pe unitate de masă este mult mai mic decât în cazul electroliților. Presiunea osmotică coloidală a proteinelor plasmatice este de numai 1,6 mOsmol / kg de apă (25 mm Hg). Aceasta este de 0,55% din osmolalitatea totală a plasmei. Cea mai mare contribuție este reprezentată de albumină (85%, Geigy). În ciuda cantității mici de osmolalitate a plasmei, presiunea osmotică coloidală este de mare importanță, deoarece proteinele pot părăsi fluxul sanguin doar încet. Din aceasta, influența presiunii coloid-osmotice asupra distribuției apei dintre plasmă și fluidul interstițial devine clară. O scădere a concentrației albuminei în plasmă, de exemplu, reduce capacitatea sa de reținere a apei (edem hipoproteinemic, recuperarea volumului circulant al sângelui).
Distribuția cationilor și anionilor în spații lichide separate
Așa cum se poate vedea din fig. 6, concentrația de electroliți în spațiile separate ale corpului nu este aceeași. Plasma și fluidul interstițial diferă substanțial numai în conținutul lor de proteine: lichidul interstițial conține aproximativ 0,4 g / dl proteină (Geigy), limfa - 3,9 g / dl (Groh și colab.). Dar plasmă este de 6,6- 8,0 g / dl (Geigy). Diferențele mici în compoziția ionică a plasmei și a fluidului interstițial sunt cauzate de secțiunea Gibbs-Donnan.
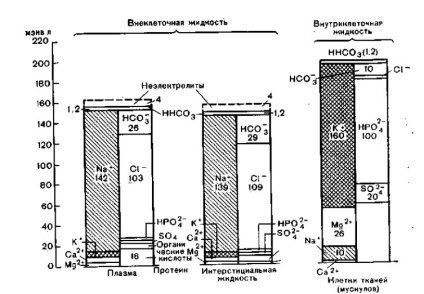
Fig. 6. Distribuția cationilor și anionilor în componente individuale în plasma meq / l sau în fluidul interstițial și în meq / kg apă pentru fluidul intracelular.
Prezentată sub forma așa-numitei monograme, jumătatea stângă a fiecărei coloane este cationii, anionii de dreapta (Geigy).
concentrație destul de diferite de electroliți în spații fluide intra- și extracelulare: extracelular conținut în principal sodiu, clor și hidrogen, în intracelulare - potasiu, magneziu, fosfat și sulfat este determinat printr-o concentrație ridicată și proteine.
Diferențele în separarea ionilor între celule și spațiul extracelular există nu numai la oameni, în și în toate animalele și plantele (Rapqport).
Aceste diferențe de concentrație se mențin în ciuda tendinței de a egaliza datorită difuziei prin membrană. Diferența de concentrație formează potențialul bioelectric necesar pentru excitabilitatea nervilor și a mușchilor. Conservare (diferențele în concentrațiile de potasiu și de sodiu între celule și spațiul extracelular a unei celule de rezervă active asociate energiei metabolice, este probabil consumat pentru mecanismele active de transport, sodiu eliminate din celulele ( „pompa de sodiu“), precum și acumularea de potasiu ("Pompa de potasiu").
Articole similare
Trimiteți-le prietenilor: