LECTURĂ 12 POTENȚIILE BIOELECTRICE
1. Fluxurile ionice în membrană.
2. Potențialul de odihnă. Ecuația Goldmann-Hodgkin-Katz.
3. Potențial de acțiune și distribuirea acesteia.
4. Concepte și formule de bază.
În organismele vii, apar diverse procese electrice. Funcționarea țesuturilor vii este însoțită de fenomene electrice. Generarea și propagarea potențialelor electrice este cel mai important fenomen fizic în celulele și țesuturile vii.
Potențialul bioelectric reprezintă diferența potențială dintre două puncte de țesut viu, care determină activitatea bioelectrică. Biopotențialul are o natură cu membrană.
12.1. Ionicul curge în membrană
Prin membrană sunt fluxuri de ioni, pentru care este valabilă ecuația Nernst-Planck (11.18):
Einstein a arătat că mobilitatea ionilor Um este exprimată în termeni de coeficientul de difuzie D și temperatura absolută T: Um = D / (RT), apoi ecuația Nernst-Planck ia forma
unde c este concentrația de ioni; R este constanta gazului universal.
În prima aproximare, putem presupune că câmpul din interiorul membranei este omogen. În acest caz, dp / dx = φm / l, unde L este grosimea membranei, iar φm este diferența de potențial dintre suprafețele sale, numită potențialul membranei. Acum ecuația lui Nernst-Planck va avea forma
Pentru a simplifica scrierea, introducem cantitatea ψ, care se numește

În celula care funcționează normal, se menține cea mai favorabilă compoziție de ioni. Diferența dintre concentrațiile lor pe diferite părți ale membranei conduce la apariția unei diferențe de potențial.
Potențialul de odihnă este diferența potențială dintre citoplasmă și mediu într-o celulă care funcționează normal.
În 1902, Bernstein a sugerat că potențialul de repaus se datorează permeabilității membranei pentru ionii K +. În repaus, densitatea fluxului de ioni este zero, iar ecuația (12.5) are următoarea formă:
Potențialul definit de formula (12.7) se numește potențialul de echilibru. Calculele efectuate cu această formulă diferă substanțial de datele experimentale la concentrații scăzute de K +. Acest lucru indică faptul că teoria potențialului "potasiu" este imperfectă.
Potențialul staționar al Goldman-Hodgkin-Katz
Motivul abaterii potențialului de echilibru din datele experimentale este permeabilitatea membranei la alte ioni care contribuie la formarea potențialului membranei. Principala contribuție la fluxul total de taxe și, prin urmare, la crearea și menținerea potențialului de odihnă, în plus față de ionii K +, Na + contribuie. Cl -. Densitatea totală a fluxului acestor ioni, luând în considerare semnele lor, este
Semnul "-" înainte de JCl indică o încărcare negativă.
În starea staționară (atunci când parametrii sistemului nu se modifică), densitatea totală a fluxului este zero, adică numărul de ioni diferiți care trece pe unitate de timp prin membrana din interiorul celulei este egal cu numărul de ioni care părăsesc celula prin membrană: J = 0
Aici, pentru a se evita dificultățile cu indexarea pentru a indica concentrația cu literele folosite în loc de paranteze: [] i și [] 0 - concentrația adecvată a ionilor din interiorul și exteriorul celulei.
Este evident că formula pentru potențialul de echilibru (12.7) este obținută din formula potențialului staționar (12.9) cu PNa = 0 și PC1 = 0. Astfel, ecuația Goldman-Hodgkin-Katz îmbunătățește în esență teoria lui Bernstein.
Cele mai multe informații despre celulele nervoase au fost obținute la studiul axonului de calmar, care a ajuns la o grosime de aproape un milimetru. Fibrele nervoase izolate își păstrează capacitatea de a transmite impulsuri nervoase pentru o lungă perioadă de timp. Se calculează potențialul staționar al membranei pentru celulele axonului de calmar. Atunci când se calculează prin formula (12.9), în locul coeficienților de permeabilitate, se poate folosi relația dintre acestea, care pentru axon este exprimată prin următoarele cifre:
Concentrațiile sunt prezentate mai jos.
Acest lucru este în acord cu valoarea determinată experimental.
12.3. Potențial de acțiune și răspândirea acesteia
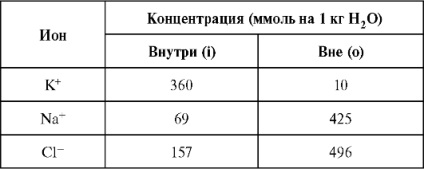
Toate celulele vii aflate sub acțiunea diferitelor stimuli trec într-o stare excitată. Când este excitat, diferența potențială dintre celulă și mediu se schimbă, apare un impuls electric și apare un potențial de acțiune. Modificarea totală a diferenței de potențial de pe membrană, care apare atunci când celulele sunt excitate, determină potențialul de acțiune.
Potențialul de acțiune este diferența potențială dintre citoplasmă și mediu în timpul excitației.
Mecanismul de propagare a potențialului de acțiune de-a lungul fibrei nervoase este luat în considerare în cursul fiziologiei normale. În acest curs, vom analiza câteva aspecte fizice ale acestui proces, care sunt ilustrate în Fig. 12.1.
Propagarea impulsului este determinată de schimbarea stării membranei. În starea de repaus (Figura 12.1, a), ca urmare a transportului activ, concentrația ionilor K + în membrană este mult mai mare
(De 36 de ori) decât în mediul extern. Pentru ionii Na +, contrariul este adevărat (concentrația de ioni de Na + în afara membranei este de 6 ori mai mare decât în interior). În același timp, există o sarcină negativă pe suprafața interioară a membranei. Când sunteți excitați, vor apărea următoarele:
1) La început, permeabilitatea membranei pentru ionii Na + crește.
Canalele de sodiu se deschid numai când sunt excitate. Na + ionele intră prin membrana din interiorul celulei, ca urmare a faptului că suprafața interioară a membranei își schimbă sarcina de la "-" la "+", adică membrana se depolarizează (figura 12.1, b). Canalul de sodiu este deschis pentru o perioadă scurtă de timp (0,5-1 msec). În acest timp, potențialul membranei variază de la -60 la +30 mV (generarea impulsurilor de 90 mV).
2) În timpul generării impulsurilor, canalul de sodiu se închide și se deschide canalul de potasiu. Ionii K + ieșesc parțial (părăsesc celula), ceea ce duce la restabilirea încărcăturii negative pe partea interioară a membranei (Figura 12.1, c). În timpul pulsului, conductivitatea membranei crește de la 1000 de ori. În total, în timpul generării unui impuls printr-un micron pătrat al suprafeței fibrelor, trec 20.000 de ioni de sodiu și potasiu.
3) Apare o perioadă refractară. Membrana nu percepe impulsul, ci revine la starea fiziologică de bază (Figura 12.1, d).
Astfel, în membrana pentru fiecare specie de ioni (în primul rând pentru sodiu și potasiu) are propriul canal, rămânând în stare deschisă sau închisă, în funcție de potențialul electric al membranei. Datorită acestui aranjament, este posibil să se asigure fluxul de rapidă a ionilor prin membrană și, în consecință, o schimbare rapidă în diferența de potențial dintre celulă și mediul înconjurător.
Canalul ionic a fost descris pentru prima dată de către R. McKinnon. Canalul constă din cavitățile exterioare și interioare separate de un filtru (Figura 12.2).
Între cavitatea interioară și corpul celulei sunt porțile. Filtrul este dificil. De obicei, ionul de potasiu sau de sodiu se deplasează în jurul celulei într-o stare hidratată: o "strat" de patru molecule de apă este atașată la ea. Filtrul conține, de asemenea
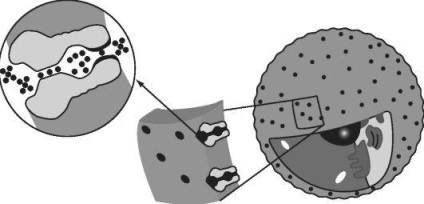
patru atomi de oxigen, care, în cazul, de exemplu, al canalului de potasiu sunt localizați exact la aceeași distanță unul de altul, pe care se află moleculele de apă din jurul ionului de potasiu. Odată ajuns în filtru, acest ion va înlocui stratul de blană și chiar și acesta nu va observa. Dacă ionul are o dimensiune diferită, de exemplu un mic ion de sodiu, atunci acesta nu va putea trece: stratul de apă nu se va desprinde și va interfera. În ceea ce privește poarta, ele se deschid ca urmare a unei schimbări în conformația proteinei. Această modificare survine ca răspuns la o schimbare a potențialului electric al membranei.
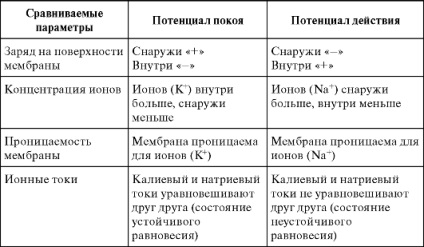
Compararea potențialului de odihnă și a potențialului de acțiune
La excitație, membrana modifică permeabilitatea selectivă: din membrana permeabilă în principal la K + devine permeabilă în principal pentru A, deoarece în afară sodiul este mai mare, tinde spre interior și reîncarcă membrana.
Tabelul 12.1 oferă o comparație a ambelor potențiale cu anumiți factori.
Tabelul 12.1. Compararea potențialului de odihnă și a potențialului de acțiune
Când membrana este depolarizată, apar curenți care sunt închise prin mediul conducător extern. Un curent electric va curge între secțiunile excitate și neașteptate ale fibrei nervoase, deoarece suprafața interioară are o încărcătură pozitivă în regiunea excitată, iar suprafața negativă în cea neexecutată și o diferență de potențial apare între ele. Acest curent local servește ca un iritant pentru zonele inexplicabile ale fibrelor nervoase care sunt direct adiacente locului de depolarizare. Există, de asemenea, excitație în ele, i. E. potențialul de acțiune (sau depolarizarea) și așa mai departe. Pe suprafața celulei, curentul local curge de la regiunea neexecutată la cea excitată; în interiorul celulei curge în direcția opusă. Curentul local, ca orice curent electric, irită zonele inexistente vecine și determină o creștere a permeabilității membranei. Aceasta conduce la apariția potențialelor de acțiune în zonele învecinate. În același timp, procesele de repolarizare apar în zona excitată anterior. Secțiunea nou excitat, la rândul său, devine electronegativă, iar curentul local care rezultă irită următoarea secțiune care o urmează. Acest proces se repetă de mai multe ori
și determină propagarea impulsurilor de excitație de-a lungul întregii lungimi a celulei în ambele direcții.
Procesul de propagare a potențialului de acțiune are loc mult mai lent decât fluxul electric local.
La vertebrate, creșterea mișcării de propagare a excitației se realizează prin mielinizarea fibrelor (fibre de carne). Fibra este acoperită cu teacă de mielină. Grosimea cochiliei este de 1 μm. Myelin este un izolator. Difuzarea ionilor prin teaca mielinei nu este posibilă. Prin urmare, în fibre, generarea potențialului de acțiune este concentrată numai în cazul în care învelișul de mielină este absent. Aceste locuri în membrană se numesc interceptări Ranvier (sau noduri active). În regiunea de interceptare, membrana este în contact cu soluția extracelulară. Lungimea interceptului este de 2 μm. De la interceptare la interceptare (brusc), impulsurile nervoase sunt transmise prin mișcarea curenților locali. Ponderea interceptărilor este de 0,02% din lungimea totală a fibrei nervoase.
Figura 12.3 prezintă modelul de propagare pentru fibrele nervoase cu interceptări Ranvier.
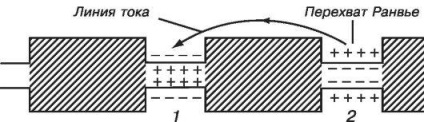
Izolația cu mielină are o mare rezistență - de sute de ori mai mare decât rezistența membranei axonului din calmar, iar capacitatea este de sute de ori mai mică. Ca rezultat, se obține un "cablu" destul de bun, iar intercepțiile cu canale și pompe joacă rolul unei surse de curent. Dacă se inițiază o interceptare, atunci curentul generat de aceasta va ajunge la următoarea interceptare aproape fără pierdere. Un curent care a abordat o altă interceptare îl excită, provoacă apariția unui potențial de acțiune în acest loc și procesul se răspândește pe toată fibra. O astfel de excitație se numește "sărituri". puls
sare repede de la o interceptare la alta, cheltuiind pe distribuție între intercepte doar câteva sute de milisecunde (50-70 μs). Cheltuielile de energie pentru o astfel de propagare a semnalului sunt mult mai mici decât pentru fibra nemyelinată, deoarece cantitatea totală de ioni de sodiu care trece prin membrana în zona de interceptare este semnificativ mai mică decât dacă s-a trecut pe întreaga suprafață a membranei.
Încălcarea tecii de mielină duce la o încălcare a propagării potențialului de acțiune de-a lungul fibrei nervoase (boli neurale severe). Studiul particularităților distribuției biopotențială este cu siguranță important pentru multe domenii de medicină.
Rata de propagare a excitației de-a lungul fibrelor nervoase ne-mielinizate este proporțională cu rădăcina pătrată a razei lor v
√R. Prin urmare, cefalopodii au mers pe calea creșterii razei fibrei nervoase, creând axoni giganți.
Invertebrate, potențialul de propagare al potențialului de acțiune este de 20-30 m / s.
Propagarea potențialului de acțiune de-a lungul fibrei nervoase se numește val de excitație. Acest val nu se distruge, deoarece primește energie din mediu - din membrana încărcată. Unda de excitație este un autowave în mediul activ al celulelor excitabile.
12.4. Concepte și formule de bază
1. Calculați pentru starea de echilibru potențialul membranar produs de ionii K +, neglijați permeabilitatea ionilor Na + și Cl -.
2. În ce timp se va extinde potențialul de acțiune la o distanță egală cu S = 10 cm dacă presupunem viteza propagării sale v = 20 m / s?
t = S / v = 0,1 / 20 = 5 x 10 -3 s. Răspunsul este: t = 5х10 -3 s.
3. Presupunând că Ci / Co = 100, temperatura T = 300 K, găsiți potențialul de repaus pentru un ion monovalent (| Z | = 1).
4. Determinați cât de mulți ioni monovalenți ar trebui să treacă de la citoplasmă la un mediu non-celular pentru a crea un potențial de repaus φm ≈ 120 mV? Luați suprafața celulei S = 10-9 m 2; Capacitatea electrică specifică a membranei (pe unitatea de suprafață) Curtea = 10 -2 F / m 2.

a) E = Δφ / h = 10 7 V / m.
b) Chiar și o mică scădere a grosimii membranei conduce la o creștere a intensității lui E și poate provoca o defectare electrică, adică afectarea membranei și moartea celulelor. Acesta este mecanismul dezvoltării diferitelor patologii care afectează membranele (în cazul oxidării peroxidului a lipidelor sub acțiunea radiației, iradierii UV, ca urmare a carcinogenezei etc.).
Răspunsul este: a) Е = 10 7 V / m.
Articole similare
-
Potențialul staționar al aurului-hodgkin, mecanismul de formare și magnitudinea lui (ecuația
-
Prezentare pe tema Departamentului de Chirurgie Maxilofacială kgmu prelegere 1 subiect și conținut
Trimiteți-le prietenilor: