

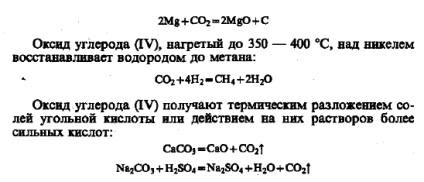
Monoxidul de carbon (II) (monoxid de carbon) este un gaz incolor, inodor în gust, slab solubil în apă. Punctul de topire este de 205 ° C, punctul de fierbere este de 191 ° C, masa moleculară relativă a CO este de 28, deci diferă puțin de aerul înconjurător. Monoxidul de carbon este o substanță otrăvitoare. Intoxicarea în formă ușoară este însoțită de amețeli, dureri de cap și vărsături. Otrare severă duce la moarte. Efectul otrăvitor al CO se datorează faptului că acesta formează un compus mai puternic decât oxigenul cu hemoglobină. În acest sens, transferul de oxigen din plămâni către țesuturi este perturbat. Gradul oficial de oxidare a carbonului +2 nu reflectă structura moleculei de CO. Molecula CO, în plus față de legătura dublă formată de electroni de carbon socializare și oxigen, există o conexiune treia suplimentară (indicată de săgeată), formată pe un mecanism donor-acceptor datorită Nepo electroni divizat perechi de oxigen: În legătură cu această moleculă durabilă CO. Monoxidul de carbon (II) nu formează sare și nu reacționează în condiții normale cu apă, acizi și alcalii. La temperaturi ridicate, este predispus la reacții de adiție și oxidare-reducere. In aer, CO ardere cu flacără albastră: Se recuperează metalele din oxizi și săruri ale acestora: sub iradiere (lumină solară directă) sau prezența catalizatorilor CO conectează cu C12 pentru a forma fosgen - gaz extrem de toxic: Co presurizat multe forme de metale CO carbonili volatile : Legătura covalentă Me-C în molecula de carbonil este formată dintr-un mecanism donator-urmăritor (pentru mai multe detalii, a se vedea § 20.4). Când sunt încălzite, carbonilii metalelor se descompun în metal și monoxid de carbon (II), care se utilizează pentru a produce metale de puritate specială. În natură, monoxidul de carbon (II) practic nu apare. Acesta poate fi format prin desecare acid formic (pregătirea de laborator): Pornind de la ultima transformare poate fi considerată în mod oficial CO anhidrida acidului formic. Acest lucru este confirmat prin următoarea reacție care are loc prin trecerea CO în topitură alcalină la presiune ridicată: oxid de carbon (IV) (dioxid de carbon, dioxid de carbon) - gazul este incolor și inodor, ușor gust acru care nu acceptă respirație și de ardere. Este ușor solubil în apă (88 volume de CO2 în 100 volume de H2O la 293 K). Dioxidul de bioxid de carbon trece într-un lichid la o temperatură normală de 60 atm. Când se răcește la -76 ° C, monoxidul de carbon (IV) este transformat într-o masă albă solidă numită gheață uscată. Dioxidul de carbon solid trece într-o stare gazoasă (sublime), ocolind lichidul. Greutatea moleculară relativă a dioxidului de carbon este de 44, deci este de 1,52 ori mai mare decât aerul. Cu o concentrație mare de monoxid de carbon (PG) în aer, oamenii și animalele sunt sufocante. În cazul în care conținutul în aer 3% în om gâfâind acolo, 10% - pierderea conștienței și de moarte, la 20% - paralizie instantanee. Monoxidul de carbon (IV) ca oxidul de acid reacționează cu oxizii de bază și alcaline: Când se dizolvă în apă, dioxid de carbon reacționează cu ea (mai puțin de 1% din cantitatea dizolvată) pentru a da acid carbonic extrem de slabă și instabilă: Pe slăbiciunea este faptul că din compuși este înlocuit chiar cu acid acetic: Dioxidul de carbon este capabil să acționeze ca agent de oxidare; prin încălzire cu carbon formează monoxid de carbon: Lit magneziu metalic centura de aer continuă pumn C02 atmosferic: monoxid de carbon (IV), se încălzește la 350 - 400 ° C, peste un nichel recuperează hidrogen la metan: monoxid de carbon (IV) se prepară prin descompunerea termică a sărurilor acidul carbonic sau acțiunea soluțiilor de acizi mai puternici asupra lor:
Articole similare
Trimiteți-le prietenilor: