Legea conservării masei de substanțe, descoperită de MV Lomonosov în 1756, prevede:
Masa substanțelor care au reacționat este egală cu masa substanțelor care rezultă din aceasta.
Purtătorii materialului din masa substanțelor sunt atomii de elemente chimice, din care sunt compuse atât substanțele (reactivii) reacționate, cât și substanțele noi rezultate (produsele de reacție). Deoarece reacții chimice atomi sunt formate n nu sunt distruse, ci doar este regruparea lor, devine evident justiție deschis MV Lomonosov și confirmată ulterior prin lege Lavoisier.
Valabilitatea legii conservării masei de substanțe poate fi ușor verificată printr-un simplu experiment. Puneți niște fosfor roșu în vas, închideți-l cu un dop și cântăriți-l pe cântar. Apoi, balonul se încălzește ușor.
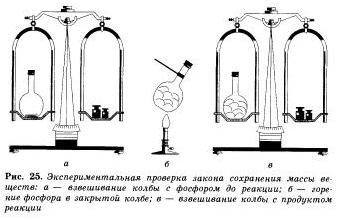
Faptul că a existat o reacție chimică. vom înțelege prin apariția unui fum alb gros într-un balon format din oxid de fosfor (V). care a fost formată prin interacțiunea fosforului cu oxigenul. Când balonul este re-cântărit cu produsele acestei reacții, vom vedea că masa substanțelor din balon nu sa schimbat, deși a avut loc conversia fosforului în oxidul său.
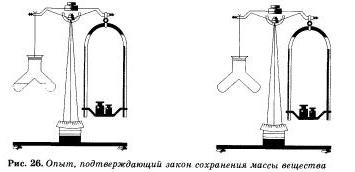
Aceeași concluzie va fi făcută și de noi în realizarea unei alte experiențe simple, dar foarte evidente. Într-un vas special se toarnă separat acid clorhidric și o soluție de alcalii, de exemplu hidroxid de sodiu. La soluția de alcaline se adaugă câteva picături de indicator - fenolftaleină, de ce soluția se va transforma în crimson. Închideți dispozitivul cu un dop, balansați balanțele pe cântare, notați masa și apoi adăugați soluțiile. Culoarea zmeurii va dispărea, deoarece acidul și alcalinii au reacționat și unul cu celălalt. Masa vasului cu produsele de reacție obținute nu sa schimbat.
În baza acestei legi, se scriu propuneri chimice, adică ecuațiile reacțiilor chimice sunt compilate folosind cuvinte chimice - formule.
O ecuație chimică este o înregistrare condiționată a unei reacții chimice folosind formule chimice și semne matematice.
În onoarea stângă, ecuațiile notează formulele (formulele) substanțelor care au reacționat, le conectează cu semnul plus. În partea dreaptă a ecuației, sunt scrise formulele (formula) substanțelor rezultate, legate de semnul plus. Între părțile ecuației puneți săgeata. Apoi găsiți coeficienții - numerele înaintea formulelor de substanțe, astfel încât numărul de atomi ai acelorași elemente din părțile stângi și din dreapta ale ecuației să fie egal.
Să scriem, de exemplu, următoarea ecuație de reacție:
Deoarece numărul de atomi de oxigen din prima parte este de două ori mai mare decât în stânga, scriem înainte de formula de apă coeficientul 2:
2H2O-> H2 + 02
Dar acum, în partea stângă a ecuației, există patru atomi de hidrogen, dar în stânga există două. Pentru egalizarea numărul de atomi de hidrogen pentru a scrie formula sa în partea dreaptă ca un factor de 2. Din moment ce acesta este egal cu numărul de atomi din fiecare element din partea stângă și dreaptă ale ecuației, înlocuim săgeata pe semnul egalității:
2H2O = 2H2 + 02
Acum, probabil, înțelegeți de ce o astfel de înregistrare se numește o ecuație.
Folosind ecuațiile reacțiilor chimice, se poate determina tipul reacției. Astfel, reacția considerată mai sus se referă la reacția i de descompunere, adică una sau mai multe substanțe simple sau complexe noi sunt formate dintr-o substanță complexă, dar dintr-o compoziție mai simplă.
Atunci când se descompune, de exemplu, se formează hidroxid de fier (III), oxid de fier (III) și apă:
Reacțiile chimice de tip opus se numesc reacții compuse. În reacția compusului intră una sau mai multe substanțe simple sau complexe, din care se formează o substanță mai complexă.
De exemplu, hidrogenul și oxigenul în timpul arderii, conectării, formează apă:
Reacția compusului se referă, de asemenea, la reacția de obținere a sulfurii de fier (II) din sulf și pulberi de fier considerate anterior. Este interesant de observat că reacțiile compusului și reacțiile de descompunere sunt însoțite de efecte termice opuse: reacțiile compusului sunt mai des exoterme. și reacții de descompunere la reacții endoterme.
Dacă o soluție de sulfat de cupru (II) pentru a coborî clipul de fier, foarte curând se transformă din cauza roșu precipitat pe acesta cu sulfat de cupru și fier (II) vor intra în soluție:
CuSO4 + Fe = FeS04 + Cu
Am scris ecuația reacției de substituție, adică o astfel de reacție, în care atomii unei substanțe simple înlocuiesc atomii unui element într-o substanță complexă.
Ca urmare a acestei reacții, se formează două substanțe noi - simple și complexe.
Pentru reacția de schimb sunt astfel de reacții, în care două substanțe complexe își schimbă părțile componente.
De exemplu, câteva picături de soluție de hidroxid de sodiu se adaugă la soluția de cupru (II) sulfat de cupru, precipită un precipitat albastru de hidroxid de cupru (II). În acest caz, se formează o altă substanță complexă - sarea sulfat de sodiu solubilă:
Dacă se adaugă o soluție de acid sulfuric la precipitatul rezultat, se observă dizolvarea precipitatului rezultat ca urmare a altei reacții de schimb:
Cu (OH) 2 + H2S04 = CuS04 + 2HOH
În consecință, ecuația reacției chimice arată ce substanțe interacționează și ce substanțe se formează, în ce relații cantitative sunt acestea și care este tipul acestei reacții.
De exemplu, ecuația
4Al + 3O2 = 2Al2O3
arată că, ca urmare a reacției compusului, patru moli de aluminiu interacționează cu trei moli de oxigen și formează doi moli de oxid de aluminiu.
1. Ecuații chimice.
2. Reacții de descompunere.
3. Reacția compusului.
4. Reacții de substituție.
5. Reacțiile de schimb.
Scrieți următoarele fraze sub formă de ecuații chimice: a) Calcinarea carbonatului de calciu produce oxid de calciu și monoxid de carbon (IV)
b) Interacțiunea dintre oxidul de fosfor (V) și apa produce acid fosforic. Care este tipul acestor reacții? Care dintre ele va fi exo - și care este endotermă?
Scrieți ecuațiile pentru următoarele scheme și specificați tipul de reacție:
Sub formulele de substanțe scrieți numele lor. Notați ecuațiile reacțiilor chimice conform următoarelor scheme:
a) acid fosforic + hidroxid de sodiu -> fosfat de sodiu + apă;
b) oxid de sodiu + apă -> hidroxid de sodiu;
c) oxid de fier (II) + aluminiu -> aluminiu + oxid de fier;
d) hidroxid de cupru (II) -> oxid de cupru (II) + apă.
Specificați tipul de reacție.
Ceea ce arată ecuația următoarei reacții chimice:
Cât de mult interacționează hidrogenul cu 1 mol de oxid de fier (III)? Ce volum de hidrogen interacționează cu 1 mol de oxid de fier (III)? Cât de mult se formează fierul? Câte molecule de apă primiți?
Dacă aveți corecții sau sugestii pentru această lecție, scrieți-ne.
Dacă doriți să vedeți alte ajustări și dorințe pentru lecții, consultați aici - Forumul educațional.
Articole similare
Trimiteți-le prietenilor: