Aceste reguli sunt utile în multe cazuri. A se vedea, de exemplu, c poate fi ușor determinată prin intermediul elementului variabil starea de oxidare (sau necunoscute) valență formula moleculară. Să presupunem că există un compus H2SO3. Care este gradul de oxidare a sulfului? Deoarece gradul de oxidare a hidrogenului întotdeauna (1), precum și gradul de oxidare a oxigenului (-2), este ușor de calculat că pozitiv și negativ gradul de oxidare „echilibru“ reciproc în molecula H2 SO3 atunci când gradul de oxidare sulf este (4). În acest caz, suma algebrică a tuturor gradelor de oxidare din moleculă este zero:
Efectul acestei reguli poate fi, de asemenea, demonstrat prin exemplul reacției sulfului cu oxigenul, în care electronii trec formal de la un atom la altul:
Înainte de reacție, sulful și oxigenul au avut același grad de oxidare zero. Ca urmare a reacției, starea de oxidare a sulfului a crescut (+4). Deci, sulful a devenit oxidat.
Gradul de oxidare a oxigenului a scăzut (-2), adică a fost restabilit oxigenul. Suma algebrică a tuturor gradelor de oxidare în SO2 a rămas zero.
Reacții similare cu diferite grade de oxidare a atomilor care reacționează sunt un număr foarte mare. Toți împreună se numesc reacții de reducere a oxidării.
În următoarele capitole vom analiza aceste reacții în detaliu, dar pentru moment vom înțelege în termeni noi.
Este atât de dificil să ne amintim ce proces - recul sau captarea electronilor - se numește oxidare și care este restaurarea. Care atom este negativ și care - un grad pozitiv de oxidare.
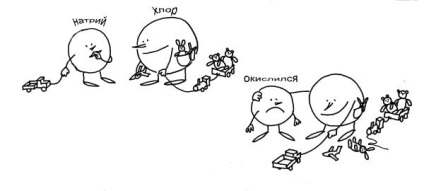
Fig. 3-11. Nu este chiar înregistrarea obișnuită a ecuației reacției chimice: Na + Cl = NaCI (a se vedea textul). Clorul este "negativ", selectează electronii altora. Sodiu "oxidat" - acest lucru se remarcă prin fizionomia acidă.
Unii dintre voi vor beneficia de orez. 3-11, care vorbește despre reacția dintre sodiu și clor, ca și când s-ar întâmpla în "grădinița chimică". În această "grădiniță" ordinele sunt aceleași ca în ordin. Chlor are câte 7 jucării (electroni). Sodiul are doar un camion (1 electron). Apoi Chlor a văzut camionul Natia și a decis că această jucărie nu avea destule! Clorul este mai puternic, așa că camionul era imediat cu el. Și că sodiul nu era rău (avea un aspect atât de oxidat!), Chlor sa oferit să joace împreună. Ce-i acolo! Desigur, toate 8 jucării de clor tras mai aproape de el, și de sodiu rămâne doar că nu se află lângă punctul de vedere „oxidat“.
Deci, ce este moralul? Clorul, desigur, este negativ. A luat electronul jucăriei altcuiva. Acum are o stare de oxidare negativă. Sodiu, desigur, oxidat - care este aspectul său "acru". Dar, de asemenea, nu părăsește clorul - nu mai există jucărie! Nu este o imagine a formării unei legături chimice într-o reacție tipică de reducere a oxidării?
Rămâne doar să adăugăm că oxidantul este refăcut în astfel de reacții. și oxidizează agentul reducător. În istoria noastră, clorul este un oxidant, iar sodiul este un agent reducător.
Articole similare
Trimiteți-le prietenilor: