Structura și funcția proteinelor
1. De ce sunt considerate proteinele polimerii?
2. Ce funcții de proteine sunt cunoscute pentru tine?
În celulele diferitelor organisme vii există peste 170 de aminoacizi diferiți, dar o varietate infinită de proteine este creată datorită unei combinații diferite de numai 20 de aminoacizi. Dintre acestea, se pot forma 2,432,902,008,176,640,000 combinații, adică diferite proteine, care vor avea exact aceeași compoziție, dar structură diferită. Dar acest număr imens nu este limita - proteina poate consta din mai multe reziduuri de aminoacizi și, în plus, fiecare aminoacid poate apărea în proteină de mai multe ori.
Molecula de acid amino este format din două părți identice pentru toți aminoacizii, din care una este o grupare amino (-NH2), cu proprietăți de bază, celălalt - gruparea carboxil (-COOH), cu proprietăți acide. Numitul radical radical (R), la diferiți aminoacizi având o structură diferită (fig. 12).
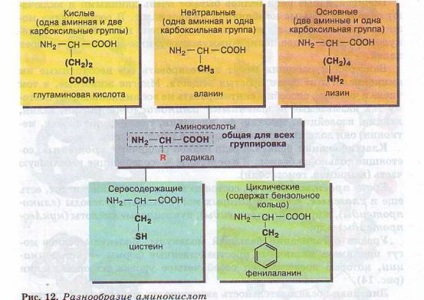
Prezența într-o singură moleculă a aminoacidului atât a grupelor bazice, cât și a grupărilor acide determină amfotericitatea și reactivitatea ridicată. Prin aceste grupuri, compușii de aminoacizi apar în timpul formării proteinelor. În timpul reacției de polimerizare, se eliberează o moleculă de apă. iar electronii eliberați formează o legătură covalentă, care se numește peptidă - se formează o peptidă (peptos greacă - gătită). La carboxilul liber și gruparea amino, pot fi adăugați alți aminoacizi, care extind "lanțul", numit polipeptidă. La un capăt al unui astfel de lanț, va exista întotdeauna un grup MH2 (acest capăt se numește N-terminal), iar la celălalt capăt un grup COOH (acest capăt se numește C-terminal) (Figura 13).
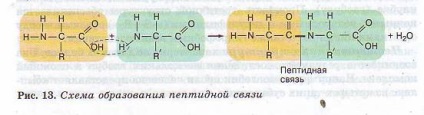
Lanturile de proteine ale polipeptidelor sunt foarte lungi și includ o mare varietate de combinații de aminoacizi. Compoziția proteică poate include nu una, ci două lanțuri de polipeptide și mai mult. Deci, într-o moleculă de insulină - două lanțuri și imunoglobulinele constau din patru lanțuri.
Bacteriile și plantele pot sintetiza toți aminoacizii care au nevoie de substanțe mai simple. Multe animale, inclusiv la om, nu sunt capabili de a sintetiza toți aminoacizii, deci așa numiții aminoacizi esențiali (lizină, valină, leucină, izoleucină, treonină, fenilalanină, triptofan, tirozină, metionină) acestea ar trebui să primească produse alimentare ca produs finit.
Proteinele se disting de proteine, constând doar din proteine, și proteine - care conțin partea non-proteică (de exemplu, hemoglobina).
În plus față de proteină simplă constând numai din aminoacizi, este de asemenea o structură complicată, care pot include carbohidrați (glicoproteine), lipide (lipoproteine), acizi nucleici (nucleoproteine) și altele.
Nivelurile de organizare a moleculei de proteine.
Moleculele de proteine pot lua diferite forme spațiale - conformații, care reprezintă cele patru niveluri ale organizației lor (Figura 14).
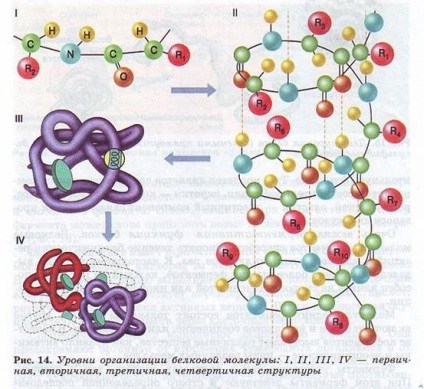
Secvența liniară a aminoacizilor din lanțul polipeptidic reprezintă structura primară a proteinei. Este unic pentru orice proteină și determină forma, proprietățile și funcțiile sale.
Structura secundară a proteinelor provine din formarea legăturilor de hidrogen între resturile de aminoacizi diferite ale grupărilor -COOH și -NH2 ale lanțului polipeptidic. Deși legăturile cu hidrogen sunt slabe, dar datorită cantității considerabile din complex, ele oferă o structură destul de puternică.
Structura terțiară este o configurație bizară, dar pentru fiecare proteină specifică, care arată ca o încurcătură (globule). Rezistența structurii terțiare este asigurată de legăturile ionice, hidrogen și disulfură (-S-S) între resturile de cisteină, precum și de interacțiunea hidrofobă.
Structura cuaternară nu este caracteristică pentru toate proteinele.
Aceasta apare ca urmare a conectării mai multor globule într-un complex complex. De exemplu, hemoglobina umană este un complex de patru astfel de subunități.
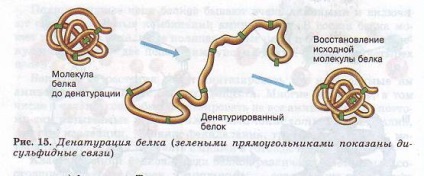
Pierderea unei molecule de proteine prin structura sa naturală se numește denaturare. Se poate produce sub influența temperaturii, a substanțelor chimice, a deshidratării, a radiațiilor și a altor factori. Dacă structura primară nu este perturbată în timpul denaturării, atunci când condițiile normale sunt restabilite, proteina este capabilă să-și reconstruiască structura (Figura 15). Rezultă că toate caracteristicile structurii macromoleculei unei proteine sunt determinate de structura sa primară.
Proteinele efectuează o varietate de funcții atât în fiecare celulă, cât și în întregul organism. Funcțiile proteinelor sunt diverse.
Proteinele sunt baza tuturor membranelor biologice, din toate organele celulei, astfel încât ele realizează o funcție structurală (clădire) - (figura 15). Deci, colagenul este o componentă importantă a țesutului conjunctiv, keratina este o componentă a penei, părului, coarnei, unghiilor, elastina este o componentă elastică a ligamentelor, pereții vaselor de sânge.
Funcția enzimatică a proteinelor este foarte importantă.
Moleculele de proteine ale enzimelor pot accelera cursul reacțiilor biochimice din celule de sute de milioane de ori. Până în prezent, mai mult de o mie de enzime au fost izolate și studiate, fiecare dintre acestea fiind capabilă să influențeze rata de curgere a unei anumite reacții biochimice.
Moleculele constau dintr-o enzimă numai din proteine includ proteine și alți compuși neproteice sau coenzimă ca coenzimă sunt diferite substanțe, cum ar fi vitaminele și regula anorganică - ionii de diferite metale.
Enzimele sunt implicate atât în sinteză, cât și în dezintegrare. La aceleași enzime acționează într-o secvență strict definită, ele sunt specifice fiecărei substanțe și accelerează doar anumite reacții. Există enzime care catalizează mai multe reacții. Selectivitatea acțiunii enzimelor asupra diferitelor substanțe chimice este legată de structura lor. Activitatea catalitică a enzimei nu este determinată de întreaga moleculă, ci de o anumită secțiune a moleculei enzimei, care se numește centrul său activ.
Substratul reacționează cu enzima și legarea substratului se realizează în activ site-ul, forma chimică și structura site-ului activ astfel încât numai anumite molecule datorită corespondenței lor spațiale pot comunica cu ei, se potrivesc împreună „ca fiind cheia de blocare.“
În stadiul final al reacției chimice, complexul enzimă-substrat se descompune pentru a forma produse finale și o enzimă liberă. Centrul activ eliberat al enzimei poate lua din nou molecule noi ale substanței substrat (Figura 16).
Funcția de transport a proteinelor este de mare importanță.
Astfel, hemoglobina transferă oxigenul din plămâni în celulele altor țesuturi. În mușchi, această funcție este efectuată de către myoglobina proteică. Albuminul seric de sânge promovează transferul de lipide și acizi grași, diverse substanțe biologic active. Vectorii de proteine poartă transferul substanțelor prin membranele celulare.
Proteinele specifice au o funcție protectoare. Protejează organismul de invazia organismelor străine și de daune. Astfel, anticorpii produși de limfocite blochează proteine străine; interferoni - proteine antivirale universale; fibrinogenul, trombina și altele protejează organismul de pierderea de sânge, formând un tromb.
Multe ființe vii furnizează proteine, numite toxine, pentru a le proteja, care în majoritatea cazurilor sunt otrăvuri puternice. La rândul lor, unele organisme sunt capabile să producă antitoxine care suprimă acțiunea acestor otrăviri.
Proteinele pot efectua o funcție energetică, fiind una dintre sursele de energie din celulă. La despicarea completă a 1 g de proteină în produsele finale, se eliberează 17,6 kJ de energie. Dar, ca sursă de energie, proteinele sunt folosite foarte rar. Aminoacizii eliberați în timpul scindării moleculelor de proteine sunt utilizați pentru a construi noi proteine.
Rolul proteinei în viața celulei este enorm. Biologia modernă a arătat că similitudinea și diferența dintre organisme sunt în cele din urmă determinate de un set de proteine. Organismele mai apropiate se află una în alta într-o poziție sistematică, cu cât proteinele lor sunt mai similare.
Proteine. Proteine. Proteid. Peptid. Peptida bond. Proteine simple și complexe. Structuri proteice primare, secundare, terțiare și cuaternare. Denaturarea.
1. Ce substanțe se numesc proteine?
2. Care este structura primară a proteinei?
3. Cum se formează structurile proteice secundare, terțiare și cuaternare?
4. Ce este denaturarea proteinelor?
5. Prin ce criterii sunt proteine împărțite în simple și complexe?
6. Care sunt funcțiile proteinelor cunoscute?
7. Care este rolul hormonilor proteici?
8. Care este funcția enzimelor proteice?
9. De ce proteinele sunt rareori utilizate ca sursă de energie?
Proteina din ou este o proteină tipică. Aflați ce se va întâmpla cu el dacă este afectat de apă, alcool, acetonă, acid, alcaline, ulei vegetal, temperatură ridicată etc.
1. Grind tubercul de cartofi brute în stare de măceșă. Luați trei eprubete și puneți câte o cantitate mică de cartofi zdrobiți în fiecare.
Plasați primul tub de testare în congelatorul frigiderului, al doilea - pe raftul inferior al frigiderului, iar al treilea - într-un borcan cu apă caldă (t = 40 ° C). După 30 de minute, scoateți eprubetele și în fiecare picătură o cantitate mică de peroxid de hidrogen. Observați ce se va întâmpla în fiecare eprubetă. Explicați rezultatele.
2. Luați trei tuburi de testare și puneți o cantitate mică de cartof crud zdrobit în fiecare dintre acestea. În primul tub de testat cu cartofi, picurați câteva picături de apă, al doilea - câteva picături de acid (oțet de masă), iar în al treilea - alcalin.
Observați ce se va întâmpla în fiecare eprubetă. Explicați rezultatele. Desenează concluzii.
Enzimele depășesc în mod semnificativ alți catalizatori pentru specificitate, activitate catalitică și sunt capabili să acționeze în condiții ușoare (temperaturi scăzute, presiune normală etc.). Sunt capabili de milisecunde pentru a asigura fluxul de reacții complexe în mai multe etape, pentru care un chimist dintr-un laborator modern ar lua zile, săptămâni sau chiar luni. De exemplu, o moleculă a enzimei catalazice scindează mai mult de 5 milioane de molecule de peroxid de hidrogen (H2O2) pe minut, care se formează în organism prin oxidarea diferiților compuși.
Deoarece moleculele de proteine, construite din aminoacizi, sunt neobișnuit de mari și complexe, un simbolism comun este folosit pentru imaginea lor. Fiecare aminoacid este desemnat prin trei litere latine.
Multe organisme vii sunt capabile să producă un aminoacid de la altul și, prin urmare, nu contează cu adevărat care aminoacizi sunt conținute în proteinele alimentare. Dar unele animale, inclusiv oamenii, ar trebui să primească un număr copleșitor de aminoacizi cu alimente, deoarece un număr de aminoacizi numiți de neînlocuit în corpul lor nu sunt produși, dar sunt necesari pentru viață.
Kamensky A. A. Kriksunov E. V. Pasechnik V. V. Biologie clasa 10
Trimise de cititori de pe site
Biblioteca online cu studenți și cărți, un plan de lecții din biologie din clasa a 10-a, cărți și manuale în conformitate cu planul calendaristic Planning Biology 10 class
Dacă aveți corecții sau sugestii pentru această lecție, scrieți-ne.
Dacă doriți să vedeți alte ajustări și dorințe pentru lecții, consultați aici - Forumul educațional.
Articole similare
Trimiteți-le prietenilor: