Moleculele constau din atomi identici sau diferiți, conectați împreună într-un întreg prin forțe de comunicare, numite legături chimice. Forțele care dețin atomi în moleculă sunt cauzate de interacțiunea electronilor externi.
Există două tipuri de comunicare. Unul dintre ele apare în acele molecule în care unii electroni externi se mișcă în jurul ambelor nuclee (ne vom limita la a lua în considerare numai moleculele diatomice). O astfel de relație se numește o legătură homopolară sau covalentă. Moleculele cu astfel de legături includ molecule cu nuclee identice (H2, N2, O2) și molecule cu nuclee diferite (de exemplu, CN).
Al doilea tip de conexiune are loc atunci când electronii din moleculă pot fi împărțiți în două grupe, fiecare dintre ele fiind întotdeauna lângă unul dintre nuclee. Electronii sunt distribuiți astfel încât aproximativ unul din nuclei să se formeze un exces de electroni, iar celălalt - lipsa lor. Astfel, molecula, așa cum a fost, constă din două ioni de semne opuse, atrase unul de celălalt. Acest tip de conexiune se numește heteropolar sau ionic. Un exemplu de legătură ionică moleculară este NaCl, KBr, HCl, etc.
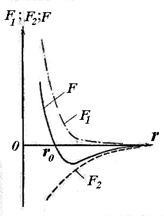
Indiferent de natura forțelor care duc la formarea unui sistem stabil de doi atomi, se pot afirma câteva considerații generale despre natura acestor forțe. Atomii localizați la o distanță considerabilă unul de altul nu interacționează unul cu celălalt. Deoarece distanța r între nucleele atomice scade, forțele de atracție reciprocă care acționează între atomi cresc (vezi Figura 11.5, F2). Cu toate acestea, aceste forțe nu sunt singurele. La distanțe scurte între atomi, se manifestă forțele repulsiei reciproce F1. care nu permite electronilor unui atom să pătrundă prea adânc în cochilii electronici ai unui alt atom. Forțele de repulsie sunt mai scurte decât forțele de atracție. Datorită acțiunii simultane a forțelor orientate opus - atracție și repulsie - la o anumită distanță r0 între atomi, ambele forțe se echilibrează și suma lor geometrică (forța rezultantă F) este zero.
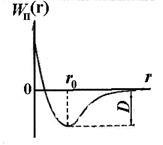
Această distanță corespunde celui mai mic potențial de energie reciprocă Wn (r) de atomi ai unei molecule diatomice. În Fig. 11.6 prezintă curba dependenței de energia potențială Wn (r) de interacțiunea a doi atomi în moleculă cu r. DistanŃa interatomică echilibrată r0 într-o moleculă se numește lungimea de legătură. Valoarea D (pe curba din Figura 11.6) determină energia de legare a moleculei. Este numeric egal cu munca care trebuie făcută pentru a rupe legăturile atomilor din moleculă.
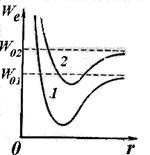
În general, schimbarea rezervelor de energie ale moleculei are loc, ca și în atom, ca urmare a unei modificări a configurației electronice care formează partea periferică a moleculei. Atunci când configurația electronică se modifică (atunci când molecula este excitată), curba dependenței energiei electronice pe distanța dintre nuclee este deplasată (vezi curbele 1 și 2 din Figura 11.7). Pentru o configurație electronică dată, atomii moleculei pot oscila unul față de celălalt și se pot roti în raport cu centrul comun de masă. Energia totală a oricărei stări staționare a moleculei poate fi reprezentată ca:
unde We este energia datorată configurației electronice, Wv este energia vibrațională a mișcării, Wr este energia mișcării de rotație.
Folosind ecuațiile mecanicii cuantice, se poate arăta că nu numai când se schimbă configurația electronică, ci și atunci când se schimbă energia mișcărilor vibraționale și de rotație, energia acestor tipuri de mișcare are valori discrete și poate fi exprimată după cum urmează:
v = 0, 1, 2, 3, ...; V - frecvența ciclică a oscilațiilor; J este numărul cuantic rotativ, care poate lua următoarele valori: J = 0, 1, 2, 3, ...; I este momentul inerției moleculei față de axă, care trece prin centrul inerției.
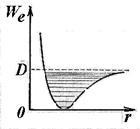
Formula (11.5) determină energia unui oscilator armonic. Pe măsură ce crește energia vibrațională (o creștere a numărului cuantic v), anharmonicitatea conduce la o convergență a nivelurilor mișcării vibraționale, având ca limită energia de disociere a moleculei (Figura 11.8).
Astfel, în conformitate cu (11.5) și (11.6), energia totală a moleculei este:
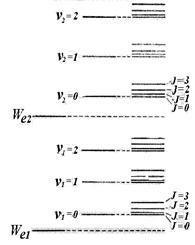
Experiența și teoria arată că distanța dintre nivelele de rotație Wr este mult mai mică decât distanța dintre nivelele vibraționale # 8710; Wv. care la rândul său este mult mai mică decât distanța dintre nivelurile electronice # 8710; Astfel, schema nivelurilor energetice ale moleculei arată cum se arată în figura 11.9 (sunt date doar două nivele electronice). Un set de niveluri este conținut în coloana din dreapta a figurii. Primele două coloane explică doar apariția nivelurilor.
Spectrele moleculare sunt foarte diferite de spectrele atomice. Spectrele atomice constau din linii separate,
spectrele moleculare constau din benzi care sunt ascuțite de la o margine și neclare de la cealaltă. Când se studiază aceste spectre cu ajutorul instrumentelor cu rezoluție înaltă, se determină cele mai importante caracteristici fizice ale moleculelor: lungimea legăturii, energia de legare și momentul inerției.
Articole similare
Trimiteți-le prietenilor: