Interacțiunea dintre molecule. Conexiuni complexe
În capitolul anterior, a fost luată în considerare interacțiunea atomilor cu formarea moleculelor, precum și structurile și unele proprietăți ale moleculelor. Prezentul capitol este dedicat interacțiunii moleculelor.
Pe măsură ce moleculele se apropie, apare o atracție care provoacă apariția unei stări condensate a materiei. Principalele tipuri de interacțiuni ale moleculelor includ forțele van der Waals, legăturile de hidrogen și interacțiunea donor-acceptor.
În 1873, omul de știință olandez I. van der Waals a sugerat că există forțe care provoacă atracție între molecule. Aceste forțe au primit ulterior numele forțelor van der Waals. Acestea includ trei componente: dipol-dipol, interacțiuni de inducție și dispersie.
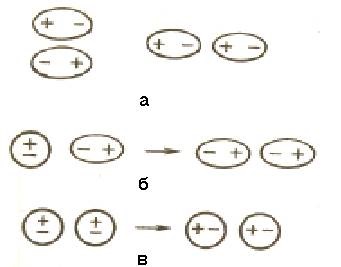
a este interacțiunea dipol-dipol; b - interacțiune de inducție;
Interacțiunea în dispersie
Figura 6.1 - Interacțiunile Van der Waals ale moleculelor
6.1.1 Interacțiunea dipol-dipol. Atunci când moleculele polare se apropie una de alta, ele sunt orientate astfel încât partea pozitivă a unui dipol să fie orientată către partea negativă a celuilalt dipol (figura 6.1a).
Interacțiunea dintre dipoli se numește dipol-dipol sau interacțiune orientată. Energia interacțiunii dipol-dipol este proporțională cu momentul electric al dipolului în gradul al patrulea și invers proporțional cu distanța dintre centrele de dipoli la puterea a șasea și temperatura absolută în primul grad.
6.1.2 Interacțiunea de inducție. Dipolii pot acționa asupra moleculelor nepolare, transformându-le în dipoli indus (indus) (Figura 6.1, b). Între apare câmpuri permanente și induse di atracție, energia care este proporțională cu momentul de dipol electric a doua putere și invers proporțională cu distanța dintre centrele moleculelor în al șaselea grad. Energia interacțiunii de inducție crește cu creșterea polarizabilității moleculelor, adică capacitatea unei molecule de a forma un dipol sub influența unui câmp electric. Valoarea polarizabilității este exprimată în termeni de volum. Polarizabilitatea în molecule de tip unic crește cu mărimea moleculelor (Tabelul 6.1). Energia interacțiunii de inducție este mult mai mică decât energia interacțiunii dipol-dipol.
6.1.3 Atracția dispersiei. În orice moleculă există fluctuații în densitatea electrică, rezultând în apariția dipolilor instant, care la rândul lor induc dipoli instant în moleculele vecine (Fig.6.1, c). Mișcarea dipolilor instantanee devine consecventă, aspectul lor și decăderea apar în mod sincron. Ca urmare a interacțiunii dipolilor instantanee, energia sistemului scade. Energia interacțiunii dispersiei este proporțională cu polarizabilitatea moleculelor și invers proporțională cu distanța dintre centrele de particule. Pentru moleculele nepolare, interacțiunea dispersiei este singura componentă a forțelor van der Waals (Tabelul 6.1).
Tabelul 6.1 - Contribuția componentelor individuale la energia interacțiunii moleculare
Momentul electric al dipolului, D
Polarizabilitatea, m 3 * 10 30
6.1.4 Energia interacțiunii van der Waals. Energia de toate felurile interacțiunii van der Waals este invers proporțională cu distanța dintre centrele moleculelor și cea de-a șasea putere.
Cu o convergență puternică a moleculelor, apar între ele forțe repulsive, care sunt invers proporționale cu distanța dintre molecule și puterea a douăsprezecea. De aceea, dependența energiei rezultante a interacțiunii EB van der Waals asupra distanței dintre molecule, IB. este exprimată prin ecuație
unde a și b sunt constante.
Energia minimă a sistemului este asigurată la distanțele dintre centrele moleculelor de 0,4 ÷ 0,5 nm, adică este substanțial mai mare decât lungimea legăturii chimice.
După cum se poate observa din tabelul 6.1, deoarece mărimea moleculelor din seriile Ar-Xe și HCI-HI crește, polarizabilitatea lor și energia atragerii dispersive cresc. Orientarea interactivă are o contribuție semnificativă la forțele van der Waals numai în cazul moleculelor cu un mare dipol electric. Cu o creștere a energiei totale a interacțiunii intermoleculare, punctul de fierbere al lichidelor crește, precum și căldura evaporării lor. Energia totală a interacțiunii moleculelor van der Waals este de 1-2 ordine de mărime mai mică decât energia legăturilor chimice.
Astfel, interacțiunile relativ slabe van der Waals, inclusiv forțele de dispersie, apar între molecule și interacțiunile dipol-dipol și interacțiunile de inducție pentru moleculele polare.
Articole similare
Trimiteți-le prietenilor: