1. O legătura chimică covalentă este formată de doi electroni cu spinuri direcționate opus și această pereche de electroni aparține la doi atomi.
2. Legătura covalentă este mai puternică, cu atât se suprapun mai mult norii de electroni care interacționează.
La scrierea formulelor structurale, perechile electronice care fac conexiunea sunt deseori reprezentate de liniuțe (în loc de puncte reprezentând electroni socializați).
Caracteristica energetică a legăturii chimice este importantă. Când se formează legătura chimică, energia totală a sistemului (molecula) este mai mică decât energia părților componente (atomi), adică EAB<ЕА+ЕB.
Valence este proprietatea unui atom al unui element chimic care atașează sau înlocuiește un anumit număr de atomi dintr-un alt element. Din acest punct de vedere, valența unui atom este cel mai ușor determinată de numărul de atomi de hidrogen care formează legături chimice cu el sau de numărul atomilor de hidrogen înlocuiți de atomul acestui element.
Odată cu dezvoltarea unor idei mecanice cuantice despre atom, valența a fost determinată de numărul de electroni neparticipați care participă la formarea legăturilor chimice. În plus față de electronii neparticipați, valența atomului depinde și de numărul de orbite goale și complet umplute ale stratului de electroni de valență.
Energia de legare este energia care este eliberată când o moleculă este formată din atomi. Energia de legare este de obicei exprimată în kJ / mol (sau kcal / mol). Aceasta este una dintre cele mai importante caracteristici ale lipirii chimice. Mai stabil este un sistem care conține mai puțină energie. Este cunoscut, de exemplu, că atomii de hidrogen tind să se unească într-o moleculă. Acest lucru înseamnă că sistemul compus din molecule de H2 conține mai puțină energie decât sistemul constând din același număr de atomi de H, dar nu combinat în molecule.
Fig. 2.1 Dependența energiei potențiale E a unui sistem de doi atomi de hidrogen la distanța internucleară r: 1 - la formarea unei legături chimice; 2 - fără formarea sa.
Figura 2.1 prezintă curba energetică caracteristică atomilor de hidrogen care interacționează. Convergența atomilor este însoțită de eliberarea energiei, care va fi cu atât mai mult, cu atât mai mult se vor suprapune norii electronici. Totuși, în condiții obișnuite, datorită repulsiei lui Coulomb, este imposibil să se realizeze fuziunea nucleelor a doi atomi. Prin urmare, la o anumită distanță în loc de atracția atomilor, repulsia lor va avea loc. Astfel, distanța dintre atomii r0, care corespunde unui minim pe curba energiei, va corespunde lungimii legăturii chimice (curba 1). Dacă rotirea electronilor atomilor de hidrogen interacțioși este aceeași, atunci va avea loc repulzarea (curba 2). Energia de legare pentru diferiți atomi variază în intervalul 170-420 kJ / mol (40-100 kcal / mol).
Procesul de tranziție a unui electron la un substrat sau nivel de energie mai mare (adică procesul de excitație sau de asociere, menționat anterior) necesită cheltuieli de energie. Atunci când se formează o legătură chimică, se eliberează energie. Pentru ca legătura chimică să fie stabilă, este necesar ca creșterea energiei atomului datorată excitației să fie mai mică decât energia legăturii chimice formate. Cu alte cuvinte, este necesar ca cheltuielile de energie pentru excitarea atomilor să fie compensate prin eliberarea energiei datorită formării unei legături.
Legătura chimică, pe lângă energia de legare, se caracterizează prin lungime, multiplicitate și polaritate. Pentru o moleculă formată din mai mult de doi atomi, unghiurile dintre legături și polaritatea moleculei ca întreg sunt importante.
Multiplicitatea legăturii este determinată de numărul de perechi de electroni care leagă cei doi atomi. Astfel, în etanul H3C-CH3, legătura dintre atomii de carbon este unică, în etilenă H2C = CH2 - dublă, în acetilenă HC0CH-triplă. Cu o creștere a multiplicitate de comunicare crește energia de legătură: energia legăturii C-C este 339 kJ / mol C = C - 611 kJ / mol și CºC - 833 kJ / mol.
Legătura chimică dintre atomi se datorează suprapunerii noriilor de electroni. Dacă se produce o suprapunere de-a lungul unei linii care leagă nucleele de atomi, atunci o astfel de conexiune se numește sigma-bond (σ-bond). Ea poate fi formată din doi electroni s, electroni s și p, doi electroni px, electroni s și d (de exemplu):
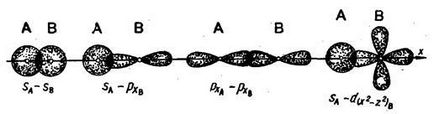
Legarea chimică, efectuată de o pereche electronică, se numește singură. O legătură simplă este întotdeauna o legătură σ. Orbaliile de tip s pot forma numai legături σ.
Legătura dintre doi atomi poate fi realizată prin mai multe perechi de electroni. O astfel de conexiune se numește multiple. Un exemplu de formare a unei legături multiple este o moleculă de azot. În molecula de azot, px-orbitalul formează o legătură σ. Atunci când o legătură este formată de pz-orbitale, apar două regiuni
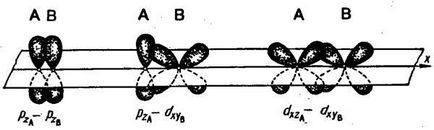
O astfel de conexiune se numește pi-conexiune (π-link). Formarea unei legături π între doi atomi are loc numai atunci când acestea sunt deja conectate printr-o legătură σ. A doua legătură p în molecula de azot este formată de atomii orbitali ai atomilor. În formarea legăturilor π, norii electronilor se suprapun mai puțin decât în cazul legăturilor σ. Din acest motiv, legăturile π sunt, de regulă, mai puțin durabile decât legăturile σ formate de aceleași orbite atomice.
p-orbitalele pot forma atât legături σ-, cât și π-; în legături multiple una dintre ele este obligatoriu o legătură σ:
Astfel, într-o moleculă de azot, una dintre cele trei legături este o legătură σ și două sunt legături π.
Lungimea legăturii este distanța dintre nucleele atomilor legați. Lungimile legăturilor în diferiți compuși au valori de zeci de nanometri. Pe măsură ce multiplicitatea lungimii legăturii crește, lungimile legăturii N-N scad. N = N și NºN sunt 0,145; 0,125 și 0,109 nm (10-9 m), iar lungimile legăturilor C-C, C-C și C-C sunt de 0,154; 0,134 și 0,120 nm.
Între atomi diferiți, o legătură covalentă pură se poate manifesta dacă electronegativitatea (EO) a atomilor este aceeași. Astfel de molecule sunt electrosimetrice, adică "Centrele de greutate" ale sarcinilor pozitive ale nucleelor și încărcăturile negative ale electronilor coincid la un moment dat, prin urmare ele sunt numite nonpolar.
Deplasarea unui nor de electroni se numește polarizare. Ca urmare a polarizării unilaterale, centrele de greutate ale încărcăturilor pozitive și negative din moleculă nu coincid la un moment dat, o anumită distanță (l) apare între ele. Astfel de molecule sunt numite polari sau dipoli. iar legătura dintre atomii din ele se numește polar.
obligațiuni Polar - un fel de legătură covalentă, care a trecut printr-o polyarizatsiyu.Rasstoyanie unilaterală minoră între „centrul de greutate“ de sarcini pozitive și negative în molecula se numește o lungime dipol. Firește, cu cât este mai mare polarizarea, cu atât lungimea dipolului este mai mare și cu atât polaritatea moleculelor este mai mare. Pentru a evalua polaritatea moleculelor sunt, de obicei permanent momentul dipolar (Mp), care este un produs al sarcinii electrice elementare (e) pe lungimea dipol (l), adică .
momentele dipolare măsurate în Debye D (D = 10-18 e. V. U. × cm, deoarece sarcina elementară este 4,810-10 e. Lungimea V. U. Dipole și media este egală cu distanța dintre cei doi atomi de miezuri, m 10-8 cm) sau coulometre (Cl × m) (1 D = 3,33 × 10-30 Cl × m) (încărcare electronică 1,6 × 10-19 Cl înmulțită cu distanța dintre încărcări, de exemplu, 0 , 1 nm, apoi Mr = 1,6 · 10-19 × 1 × 10-10 = 1,6 · 10-29 Cl · m). Momentele dipolului constant al moleculelor au valori de la zero la 10 D.
Pentru moleculele nepolare, l = 0 și Mp = 0, adică ei nu au un moment dipol. Pentru moleculele polare, Mp> 0 și atinge valori de 3,5 - 4,0 d.
Cu o diferență foarte mare în atomii EO a fost în mod clar polarizarea unilaterală: electron nor comunicație maximal deplasat spre atomul cu cel mai mare atomii EO trec în ioni și molecule încărcate oppositely ionice are loc:
Legătura covalentă devine ionică. Electrozimetria moleculelor crește, lungimea dipolului crește, momentul dipolului crește la 10 D.
Momentul dipol total al unei molecule complexe poate fi considerat egal cu suma vectorilor din momentele dipol ale legăturilor individuale. Momentul dipolului este de obicei considerat a fi direcționat de la capătul pozitiv al dipolului la cel negativ.
Predicția polarității cuplării se poate face cu ajutorul unor atomi relativi de EO. Cu cât diferența dintre EO relativă a atomilor este mai mare, cu atât polaritatea este mai puternică: DEO = 0 - legătura covalentă nepolară; DOO = 0 - 2 - legătura covalentă polară; DEA = 2 - legătura ionică. Este mai corect să vorbim despre gradul de ionicitate al legăturii, deoarece legăturile nu sunt ionice cu 100%. Chiar și în compusul CsF, legătura ionică este de numai 89%.
Legătura chimică care rezultă din tranziția electronilor de la un atom la un atom se numește ionică. iar moleculele corespunzătoare ale compușilor chimici sunt ionice. Pentru compușii ionici în stare solidă, este caracteristică o rețea de cristal ionic. În stare topită și dizolvată, ele conduc curent electric, au o temperatură ridicată de topire și fierbere și un moment dipol semnificativ.
Dacă luăm în considerare compușii de elemente ale oricărei perioade cu același element, apoi ca mișcarea de la începutul până la sfârșitul perioadei, caracterul predominant ionic al legăturii este înlocuit cu un caracter covalent. De exemplu, fluorurile din a 2-perioada LiF, BeF2, CF4, NF3, OF2, F2 comunicație ionicity de fluorură de litiu și, treptat, slabeste în mod tipic înlocuit printr-o legătură covalentă la o moleculă de fluor.
Articole similare
Trimiteți-le prietenilor: