Una dintre proprietățile unice ale organismelor vii este capacitatea lor remarcabilă de a menține echilibrul în procese (biosintetice) catabolice (biodegra-dativ) și anabolizanți. În același timp, procesele de sinteză, descompunere și interconversie a sute și mii de substanțe diferite sunt efectuate simultan în celule. care, la rândul lor, sunt reglementate de o varietate de mecanisme care asigură constanța mediului intern al corpului. Unele dintre aceste mecanisme de reglementare, printre care un rol important aparțin mecanismelor de reglare a sintezei și a activității catalitice a enzimelor. vor fi discutate în continuare.
Influența legii acțiunii în masă. În reacția chimică reversibilă catalizată de enzimă. de exemplu A + B <=> C + D, concentrația componentelor de reacție și, în consecință, direcția reacției vor fi reglementate de influența legii acțiunii în masă. În particular, aceasta poate fi demonstrată într-o reacție de transaminare reversibilă. catalizată de enzima aminotransferază:
Alanină + # 945; -Ketoglutarat <=> Piruvat + glutamat.
Acest tip de reglementare joacă în mod evident doar un rol limitat, deoarece, în condiții reale, în general, reacția are loc într-o singură direcție, deoarece produsele rezultate pot fi substraturi pentru acțiunea altor enzime, și ieșirea din zona de reacție. În aceste cazuri, se stabilește mai degrabă o stare stabilă (staționară) decât un adevărat echilibru.
Schimbarea cantității de enzimă. La bacterii a fost bine studiat fenomen indus (inductoare) sintetizarea enzimei atunci când este crescută pe un mediu în care unica sursă de carbon și energie este unul sau altul carbohidrat. de exemplu glucoza. Înlocuirea glucozei în mediu pe lactoză (inductor) conducând la galactozidaza enzimă de sinteză indusă sau adaptivă (după o ușoară perioadă de fază lag) (gena lactoză programată. Vezi cap. 13), care scindează lactoza în glucoză și galactoză.
În celulele procariotelor și eucariotelor există enzime. a căror concentrație nu necesită adăugarea unui inductor; acestea sunt așa-numitele enzime constitutive. Cantitatea de enzimă din celulă depinde de prezența produsului de reacție. catalizată de această enzimă. produsul reacției determină inhibarea sintezei enzimelor ca rezultat al represiunii (a se vedea mai jos).
În țesuturile animale, o sinteză rapidă de enzime este observată mai rar. Mecanismul său (inducerea sintezei) a fost studiat numai pentru un număr mic de enzime. tirozin transaminază, serin și treonin dehidratază, pirolază de triptofan, etc. - ca răspuns la introducerea hormonilor sau la recepția alimentelor proteice. Cu toate acestea, atunci când anumite otrăviri, substanțele cancerigene intră în organism. alcaloizi. insecticidele după câteva zile se observă o creștere accentuată a activității (în mod corespunzător, a cantității) de enzime-hidroxilaze (monooxygenaze) din rețeaua endoplasmatică a celulelor hepatice. oxidarea substanțelor străine în produse netoxice pentru organism. Este perfect permis să presupunem că în aceste cazuri, enzimele sunt sintetizate prin inducție (de novo). Există cazuri în care, sub acțiunea unor hidroxilaze similare, substanțele străine sunt transformate în compuși mai toxici în organism. Acest fenomen, inversul dezintoxicării, a fost numit sinteza letală.
Proenzime. Enzimele proteolitice ale tractului digestiv și pancreas sunt sintetizate într-o formă inactivă - ca proenzime (proenzime). Reglementarea în aceste cazuri reduce la conversia proenzimelor în enzime active sub influența agenților specifici sau a altor enzime - proteinaze. Astfel, tripsina din pancreas este sintetizată sub formă de tripsinogen inactiv. Intrarea în intestin este convertit la tripsina autocataliză activă rezultată sau sub influența altor proteaze (mecanism activat este discutat în detaliu în capitolul 12). Conversia Pepsi nogena inactiv în pepsina activă se produce autocatalitic prin proteoliză limitată în mod specific în prezența acidului clorhidric și este de asemenea asociat cu scindarea peptidei inhibitor specific proenzimei. Aceste transformări ale zymogens în enzime active sunt asociate cu modificări conformaționale în molecula enzimei și formarea unui centru activ sau deschiderea acestuia (demascarea). Sinteza proteaze într-o formă inactivă și un număr de alte proteine precursoare inactive, evident, are un anumit sens biologic, prevenind distrugerea organismelor de celule în care se formează proenzime. Exemple de astfel de activare este activarea anumitor proteine, hormoni (proinsulina -> insulină), proteine de țesut conjunctiv (procolagen solubil convertit la colagen insolubil), proteine ale sistemului de coagulare a sângelui.
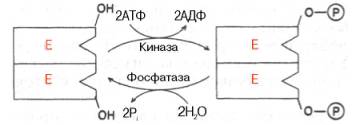
Fig. 4.23. Modificarea covalentă a enzimei prin fosforilarea-defosforilarea resturilor de serină.
Fig. 4.24. Modificarea ne-covalentă a enzimei prin adenilare-deadenilare.
Modificarea chimică a enzimei. Mai multe tipuri de proteine în formarea postsynthetic structurii terțiare supuse modificărilor chimice (vezi cap. 1). Sa dovedit că activitatea unui număr de enzime-cheie de metabolismul carbohidraților. . In particular fosforilaza, glicogen, etc este de asemenea controlată prin fosforilare și defosforili-TION, implementată de enzime specifice - protein kinaza si proteinfosfataze, care la rândul său, activitatea este reglementată de hormoni (a se vedea capitolul 10.). Nivelul activității enzimelor cheie ale metabolismului glucidic și astfel intensitatea și direcția schimbului proceselor însele sunt determinate de raportul dintre formele fosforilate și de-fosforilate ale acestor enzime.
De obicei, se distinge covalente reversibil și necovalente enzime modificări chimice. realizată prin grupările OH ale serinei. mai puțin frecvent - tirozină sau datorită interacțiunilor necovalente cu molecula enzimei. În primul caz, enzima este activă sau fosfo-rilirovannaya sau formă defosforilat, așa cum este cazul cu moleculele de fosforilază glicogen muscular și respectiv (vezi cap. 10). Exemplele care pot fi sub forma a două circuite prezente tip modificare în care simbolul R reprezintă un rest de fosfat. Pi - fosfat anorganic (H3 PO4) IPP - pirofosfat anorganic (H4 P2 O7), AMP - (. Figura 4.23, 4.24) rest de acid adenilic.
Chimice enzime de modificare postsynthetic includ, în plus, procesele de proteoliză limitată (vezi. Anterior), metilarea (vezi cap. 13), uridilirovaniya glicozilare, adenilare, ADP-ribozilarea și altele. Astfel, oferind o microscopice
Reglementarea allosterică. În multe reacții strict biosintetice, principalul tip de reglare a ratei unui proces enzimatic în mai multe etape este inhibarea prin principiul feedback-ului. Aceasta înseamnă că produsul final al lanțului biosintetic suprimă activitatea enzimei. catalizând prima etapă a sintezei, care este esențială pentru acest lanț de reacții. Deoarece produsul final este structural diferit de substrat. se leagă de centrul alosteric (necatalitic) al moleculei enzimei. determinând inhibarea întregului lanț al reacției sintetice.
Să presupunem că se desfășoară un proces biosintetic în mai multe etape în celule, fiecare etapă a căruia este catalizată de propria sa enzimă:
Rata unei astfel de secvențe totale de reacții este determinată în mare măsură de concentrația produsului final P, a cărui acumulare peste nivelul admisibil exercită un puternic efect inhibitor asupra primei etape a procesului și, în consecință, asupra enzimei E1.
Existența unui astfel de mecanism de control al metaboliților activității enzimatice au fost găsite în E. coli la un izoleucina studiu de sinteză și CTP. Sa dovedit că izoleucina. care este produsul final al sintezei, inhibă selectiv activitatea dehidraza treonină, care catalizează prima etapă a procesului de conversie în serie a treoninei la izoleucină. care constă din cinci reacții enzimatice:
În mod similar, CTP ca produs final al căii biosintetice are un efect inhibitor asupra primei enzime (aspartat carbamoiltrans-sfera), regulând astfel sinteza proprie (vezi capitolul 13). Acest tip de inhibiție se numește inhibare prin principiul feedbackului sau retroinhibiției. Existența sa este dovedită în toate organismele vii. În prezent, este considerat unul dintre principalele tipuri de reglementare a activității enzimatice și a metabolismului celular în general.
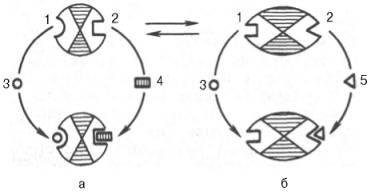
Fig. 4.25. Interacțiunea enzimei alosterice cu substratul și efectoarele (schema).
a este un complex activ; b - complex inactiv; 1 - centru activ; 2 - centru alosteric; 3 - substrat; 4 - efectoare pozitivă; 5 - efector negativ.
Pe de altă parte, în procese amfiblice care efectuează simultan funcții biosintetice și biodegradabile. Existența reglementării atât a tipului de retroinhibare cât și a compușilor macroergici - indicatori ai stării energetice a celulei este dovedită. Pentru procesele amfiblice, un tip unic de reglaj specific numai lor este, în plus, activarea de către precursor. când primul metabolit din calea multistratului activează enzima. catalizând ultima etapă. Astfel, este demonstrată influența activă a glucoz-6-fosfatului, care este un precursor al glicogenului. pe enzima glicogen sintaza.
Astfel de tipuri de inhibiție de către produsul final și de activare de către primul produs sunt caracteristice enzimelor alosterice (de reglementare). când efectorul, modulatorul, este structural diferit de substrat. este legat în centrul special (alosteric) al moleculei de enzimă. spațial îndepărtat de centrul activ. Cu toate acestea, trebuie avut în vedere faptul că modulatorii enzimelor alosterice pot fi atât activatori. și inhibitori. Se dovedește deseori că substratul însuși exercită un efect de activare. Enzime. pentru care și substratul. și modulatorul sunt reprezentate de structuri identice, sunt numite omotropice, spre deosebire de enzimele heterotrofice. pentru care modulatorul are o structură diferită de substrat. Interconversia enzimelor alosterice active și inactive într-o formă simplificată, precum și modificările conformaționale observate la adăugarea unui substrat și a efectorilor sunt arătate în Fig. 4.25. Adăugarea unui efector negativ la centrul allosteric provoacă schimbări semnificative în configurația centrului activ al moleculei enzimatice. în urma căruia enzima își pierde afinitatea la substratul său (formarea unui complex inactiv).
interacțiunile alosterice se manifestă în viteza de reacție inițială curbe de caractere pe concentrația substratului sau efector, în special în S curbele imagisticii (abaterea de la curba hiperbolic Michaelis-Menten). S formă de dependență de v [S] în prezența modulatorului datorită efectului cooperativity. Aceasta înseamnă că legarea unei molecule a substratului facilitează legarea celei de-a doua molecule în situsul activ. contribuind astfel la o creștere a ratei de reacție. Mai mult, enzimele allosteric de reglementare pentru caracteristica neliniară a dependenței vitezei de reacție de concentrația substratului.
Alte tipuri de reglare a activității enzimatice. Cantitatea absolută a enzimei prezente în celulă este reglată de momentul sintezei și decăderii sale. Mecanismele de reglementare pot include și concurența enzimelor pentru un substrat comun. oprirea activității unuia dintre izoenzimele (în forme multiple de enzime), efectul concentrării-
cofactorii și fenomenul de compartimentare. Mecanismul Party-mentalisation comunist procesele metabolice este, aparent, un rol important biologice spatial secționarea prin biomembranele enzime cu substraturi lor (de exemplu, enzimele lizozomale proteinaza, fosfataza, RNaza si alte enzime hidrolitice -... A Substanțe citoplasmatice pe care acestea acționează) . În plus, facilitând reglementarea independentă, acest mecanism vă permite să împartă incompatibile în același loc (și, eventual, în același timp) procesele metabolice. Un exemplu al celor din urmă ar putea fi modurile de sinteză a acizilor grași mai mari. care apar în principal în fracția solubilă a citoplasmei. și modalități de descompunere (oxidare) a acizilor grași. concentrat în mitocondrii. Cu toate acestea, trebuie subliniat faptul că, atunci când există o delegare comună, apare problema transportului ca metaboliți. și reducerea echivalenților prin biomembrane ale organogramelor subcelulare. Această problemă este rezolvată printr-un mecanism de transfer așa-numit, care permite transferul de metaboliți în formele capabile să treacă prin membrană. și asigurarea homeostazei intracelulare (vezi Capitolul 13).

Trimiteți-le prietenilor: