Subiect: CIRCUIT MITOCHONDRIAL RESPIRATORY. FOSFORILAREA OXIDIZĂRII
1. Structura lanțului respirator mitocondrial, secvența transferului de protoni și electroni. Formule de acceptoare de hidrogen: NAD, FAD, KoQ. Rolul oxigenului în lanțul de transfer de electroni.
2. Complexele enzimatice ale lanțului respirator - compoziție, funcție. Potențialul transmembranar, formarea și utilizarea acestuia. Rolul membranei mitocondriene interne.
3. Conceptul de fosforilare oxidativă. Coeficientul de fosforilare (definirea conceptului, exemplu de calcul). Rolul sintetazei ATP. Direcțiile principale ale utilizării ATP în celulă. Formula ATP.
4. Echilibrul energetic (randamentul ATP) al oxidării acetatului activ (acetil-CoA) și piruvatului.
5. Oxidarea non-fosforilarea sau libera a substraturilor este un rol biologic. Disocierea oxidării și fosforilării în mitocondrii.
6. Substanțe care afectează fosforilarea oxidativă în mitocondriile: inhibitori ai sistemului respirator, protonofori, ionofori.
Ciclul respirator și fosforilarea oxidativă.
14.1.1. Reacția piruvatdehidrogenazei și în ciclul Krebs are loc dehidrogenare (oxidare) a substraturilor (piruvatului, isocitrate, α-cetoglutarat, succinat, malat). Rezultatul acestor reacții produc NADH și FADH 2. Aceste coenzime reduse sunt oxidată în lanțul respirator mitocondrial. Oxidarea NADH și FADH 2 curge conjugately cu sinteza ATP din ADP și H 3 PO 4 este numită fosforilării oxidative.
Structura mitocondriilor este prezentată în Figura 14.1. Mitochondria sunt organele intracelulare cu două membrane: membrana exterioară (1) și membrana interioară (2). Membrana internă mitocondrială formează numeroase pliuri - cristae (3). Spațiul delimitat de membrana mitocondrială internă, se numește matricea (4), spațiul delimitat de membranele exterioare și interioare - spațiu intermembrane (5).
Figura 14.1. Structura mitocondriilor.
14.1.2. Respiratorii lanț - enzime de circuit seria realizează transferul de ioni de hidrogen și electroni prin oxidarea substraturilor la oxigen molecular - final acceptor de hidrogen. În timpul acestor reacții, eliberarea de energie are loc treptat, în porții mici, și poate fi acumulată sub formă de ATP. Localizarea enzimelor din lanțul respirator este o membrană internă mitocondrială.
Lanțul respirator include patru complexe multi-enzimatice (Figura 14.2).
Figura 14.2. Complexele enzimatice ale lanțului respirator (sunt indicate zonele de conjugare a oxidării și fosforilării):
I. NADH-KoQ-reductaza (conține acceptori intermediari ai hidrogenului: flavon mononucleotid și proteine de fier-sulf). II. Succinat-KoQ-reductază (conține acceptori intermediari de hidrogen: FAD și proteine cu sulf-sulf). III. KoQH 2-citocrom c-reductază (conține acceptori de electroni: citocrom b și c 1. proteine cu deficit de fier). IV. Citocrom c-oxidază (conține acceptori de electroni: citocromii a și a 3 ioni de cupru Cu 2+).
14.1.3. Ca purtători intermediari ai electronilor sunt ubiquinona (coenzima Q) și citocromul c.
Ubichinonă (KoQ) - liposolubile substanță asemănătoare vitaminelor, care este capabil să difuzeze cu ușurință în faza hidrofoba a membranei interioare a mitocondriilor. Rolul biologic al coenzimei Q - transportul de electroni în lanțul respirator al flavoproteinelor (complexele I și II) la citocromii (complex III).
Citocromul c - complexul chromoprotein proteine, a cărui grupare prostetică - hem - conține fier variabilă de valență (Fe 3+ în formă oxidată și Fe 2+ în formă redusă). Citocromul c este un compus solubil în apă și este situată la periferia membranei mitocondriale în faza hidrofilă. Rolul biologic al citocromului c este transferul de electroni în lanțul respirator de la complexul III la complexul IV.
14.1.4. Suporturile de electroni intermediare din lanțul respirator sunt localizate în conformitate cu potențialul lor de reducere a oxidării. În această secvență, capacitatea de a elibera electroni (oxidare) scade, iar capacitatea de a atașa electronii (recupera) crește. Cea mai mare capacitate de a da electroni are NADH, cea mai mare capacitate de a atașa electronii - oxigen molecular.
Figura 14.3 prezintă structura regiunii reactive a unor purtători intermediari ai protonilor și electronilor în forma oxidată și redusă și interconversia lor.
Figura 14.3. Interconversia formelor oxidate și reduse de purtători intermediari de electroni și protoni.
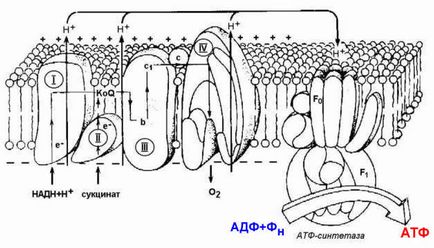
Figura 14.4. Localizarea enzimelor lanțului respirator și sintetazei ATP în membrana interioară a mitocondriilor.
Protonii extrași în spațiul intermetalic datorită energiei de transfer de electroni sunt transferați din nou în matricea mitocondrială. Acest procedeu se realizează prin sintezazei ATP dependentă de enzima H + (H + -ATPaza). Enzima este format din două părți (a se vedea figura 10.4.): Porțiune solubil în apă a catalizatorului (F 1) și imersate în canalul de membrană hidrofilă (F 0). Tranziția de ioni H + dintr-o regiune mai mare pentru a scădea concentrația acestora însoțită de eliberarea de energie liberă, datorită cărora este sintetizat ATP.
14.1.6. Energia acumulată sub formă de ATP este utilizată în organism pentru a furniza o varietate de procese biochimice și fiziologice. Amintiți-vă principalele exemple de utilizare a energiei ATP:
1) sinteza substanțelor chimice complexe de la cele mai simple (reacții anabolice); 2) contracția musculară (lucrări mecanice); 3) formarea biopotențială transmembranară; 4) transportul activ al substanțelor prin membrane biologice.
14.2.1 Gradul de conjugare a oxidării și fosforilării în mitocondrii caracterizează coeficientul de fosforilare (P / O). Este egal cu raportul dintre numărul de molecule de fosfat anorganic (H3PO4), convertit în ATP, la numărul de atomi de oxigen consumat (O2).
De exemplu, dacă donatorul de hidrogen pentru lanțul respirator este molecula NADH. electronii de la donator (NADH) la un acceptor (oxigen) sunt 3 situsuri de conjugare de oxidare și fosforilare (I, III și IV enzime complexe ale lanțului respirator). Astfel, 3 molecule de ATP (3 ADP + 3 H 3 PO 4 → 3 ATP) pot fi formate cât mai mult posibil. Un atom de oxigen (2 H + O → H 2 O) este consumat. Valoarea coeficientului P / O = 3/1 = 3.
În cazul în care donorul de hidrogen este molecula de FADH 2 în porțiunea de circuit de respirație 2 electroni trec conjugarea oxidării și fosforilării (III și IV enzime complexe ale lanțului respirator). Astfel, formarea maximă posibilă a 2 molecule de ATP (2 ADP + 2 H 3 PO 4 → 2 ATP). Ca și în cazul precedent, se consumă 1 atom de oxigen (2 H + O → H 2 O). Valoarea coeficientului P / O = 2/1 = 2.
14.2.2. Un exemplu mai complex al calculului coeficientului de fosforilare - în oxidarea piruvatului la produsele finale - este prezentat în Figura 14.5. Aceasta cale se produce dehidrogenare 4 substraturi (piruvatul, isocitrate, α-cetoglutarat și malat) pentru a forma NADH și un substrat (succinat) FADH 2 pentru a forma coenzima redusa oxidat în lanțul respirator și în reacțiile de fosforilare conjugat produs (4 x 3 ATP + 1 x 2 ATP) = 14 molecule ATP. O altă moleculă de ATP (GTP) se formează în reacția de fosforilare a substratului la nivelul succinil-CoA. Astfel, prin oxidarea completă a 1 moleculei de piruvat, se formează 15 molecule ATP (14 dintre acestea - prin fosforilare oxidativă).
Pentru a calcula cantitatea de oxigen consumată, trebuie să cunoașteți numărul de reacții de dehidrogenare într-o anumită secțiune a căii metabolice. Pentru a oxida fiecare formă de coenzimă redusă, este necesar un atom de oxigen (vezi mai sus). În consecință, în exemplul nostru, 5 atomi de oxigen sunt consumați. Valoarea raportului P / O va fi de 14/5 = 2.8.
Figura 14.5. Calcularea bilanțului energetic al reacțiilor de decarboxilare oxidativă a piruvatului și a ciclului Krebs.
Disocierea respirației și a fosforilării.
14.3.1. Transferul electronilor în lanțul respirator nu se realizează în toate cazurile coroborat cu fosforilarea ADP. Starea în care are loc oxidarea substraturilor în lanțul respirator, dar ATP nu este formată, se numește oxidare liberă (non-fosforilarea). Energia eliberată în timpul oxidării este disipată sub formă de căldură.
Disocierea oxidării și fosforilării în mitocondrii poate avea loc în anumite condiții patologice. Principalele simptome ale unor astfel de afecțiuni pot fi oboseala rapidă, creșterea temperaturii corporale, scăderea în greutate, în ciuda creșterii apetitului, a respirației și a palpitațiilor.
14.3.2. Disocierea proceselor de oxidare și fosforilare poate fi cauzată de acțiunea unui număr de substanțe, atât naturale cât și sintetice. Mecanismul de acțiune al acestor substanțe este că aceștia sunt purtători de protoni prin membrană. Substanțele care disociază oxidarea și fosforilarea pot fi împărțite în protonofori și ionofori.
Protonophores sunt acizi hidrofobi organici slabi, care, în forma anion (R-COO -) protoni se leaga in spatiul intermembrane, difuza prin membrană și se disociază într-o matrice pentru a forma protoni. Acestui grup aparțin, de exemplu, acizi grași liberi, hormoni tiroidieni, salicilați, dicumarol, 2,4-dinitrofenol (vezi. Figura 14.6).
Figura 14.6. Mecanismul de acțiune al 2,4-dinitrofenolului.
Ionofori (valinomycin, nigeriicin gramicidin) sunt capabile să fie încorporate în membrană, formând un canal prin care se pot deplasa protonii și alți cationi monovalenți - Na + sau K + (figura 14.7). Ca rezultat, potențialul de proton este îndepărtat și sinteza ATP este întreruptă.
Figura 14.7. Valinomicina facilitează penetrarea ionilor de H + în celulă.
Articole similare
Trimiteți-le prietenilor: