Un alt exemplu important de deviere de la echilibru este formarea de faze metastabile în procesul de transformări de fază. Acesta este numele fazelor de neechilibru, care sunt în unele cazuri:
a) etapa de tranziție dintre faza inițială și faza de echilibru,
b) o fază care este stabilă la anumite presiuni, temperatură și concentrații.
În diagramele de echilibru de fază, echilibrele metastabile sunt reprezentate de linii punctate.
faze metastabile formate prin cristalizarea substanțelor elementare și a aliajelor binare cu topiturile subrăcire substanțiale (soluții), și temperatura și concentrația intervalul în care aceste faze sunt metastabile, are o lungime diferită. potențial izobară-izotermă a fazei metastabile este mai mică decât cea a originalului, dar mai mare decât faza de echilibru, astfel încât transformarea fazei metastabile în echilibru necesită o anumită energie de activare, în absența unei faze metastabile poate exista la infinit.
Formarea fazelor metastabile este un fenomen adesea observat și folosit pe scară largă și în transformările în stare solidă. Aceasta include, în primul rând formarea de soluție solidă suprasaturată dacă descompunerea lor se efectuează la temperaturi joase, atunci când difuzarea și formarea fazelor de echilibru, respectiv, impiedicata.
Există toate motivele să credem că observate în semiconductori puternic dopate mismatching a concentrației de impurități electric active și concentrația totală (chimică) (impurități Polytropic) sale este, în unele cazuri, rezultatul etapelor inițiale ale descompunerii soluției solide, în care procedeu implică impurități formate fază metastabilă.
Pentru a descrie fazele metastabile, folosiți diagrame speciale de echilibru de fază a fazelor metastabile - așa-numitele diagrame metastabile. Regiunile de metastabilitate și compuși chimici metastabili din astfel de diagrame sunt prezentate printr-o linie punctată. Problema aplicării regulii de fază în diagramele metastabile este controversată. În Fig. 9.3 prezintă diagramele de echilibru de fază ale sistemelor Co-C și Ni-C și diagramele metastabile ale acestor sisteme.
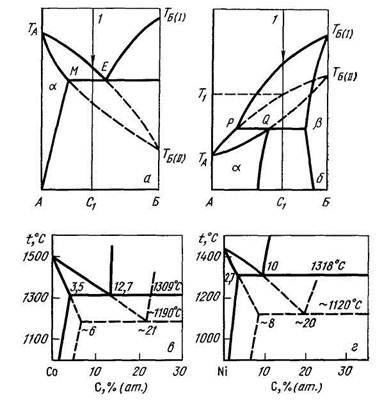
Fig. 9.3. Diagrame metastabile (linii solide - echilibru stabil, punctat - metastabil): a - o posibilă echilibru metastabil în diagrama tip eutectică; b - echilibre metastabile posibile în diagrama de tip peritectic; c este diagrama metastabila a sistemului Co-C; r este diagrama metastabilă a sistemului Ni-C.
Valoarea metastabilității este determinată de diferența dintre energiile fazei metastabile și amestecul de faze stabile. La rate foarte mari de răcire (10 Februarie - 10 10) K / s topiturilor suprarăcite (soluții) sub o anumită temperatură poate fi obținută fază metastabilă solidă nu numai într-un cristalin, ci într-o stare amorfă (când o fază este ordine rază scurtă de acțiune și nu există nici o ordine cu rază lungă în aranjamentul atomilor). Aliajele în stare amorfă pot fi obținute nu numai în timpul cristalizării din faza lichidă, dar și în precipitarea din faza gazoasă. Pentru a obține faze cu un tip de legătură covalentă într-o stare amorfă, sunt necesare rate de răcire mai scăzute, comparativ cu fazele cu un tip de legătură metalic.
Cunoașterea diagramei echilibrului de fază este, de asemenea, necesară atunci când se aleg compozițiile fazei lichide și condițiile de temperatură de cristalizare. Acest lucru este deosebit de important în prepararea cristalelor compuse. Să luăm în considerare acest lucru în exemplul de obținere a cristalelor unice prin extragerea acestora din faza lichidă prin metoda Czochralski.
Cristalizarea are loc pe un cristal de însămânțare în contact cu suprafața topiturii lichide supercoolizată de # 8710; T sub temperatura lichidului. Această răcire superioară este menținută pe parcursul întregului proces de cristalizare. Pe măsură ce noile straturi ale fazei solide cristalizează pe semințe, cristalul este extras din faza lichidă. Compoziția fazei solide cristalizante este determinată de diagrama de echilibru de fază, dacă în timpul întinderii sunt menținute condițiile apropiate de echilibru (viteza de cristalizare este mică, procesele de difuzie în fazele solide și lichide sunt larg dezvoltate, adică # 8710; T → 0).
Congruent compus de topire, de exemplu GATE și GA2 Te3 (vezi. Fig. 8.2 a. L. 8) poate fi preparat din faza lichidă din aceeași compoziție ca și cea a compusului. Ele pot fi preparate prin cristalizare din topitură și o compoziție ușor diferită: de exemplu, Porții compus - compoziția topiturii X1 de cristalizare la o temperatură cuprinsă în intervalul cuprins între 1100 și 1019 K. Cu toate acestea, trebuie remarcat faptul că în cazul în care compusul are un anumit interval de omogenitate, atunci cristal tras nu va avea o compoziție stoechiometrică, și va fi o limită de concentrație soluție solidă pe baza compusului, temperatura de echilibru cristalizare.
Compușii cu topire incongruentă nu pot fi obținuți dintr-o fază lichidă cu aceeași compoziție. Astfel, în Fig. 8.2, l. 8 arată că dintr-o fază lichidă care corespunde compoziției la GaTe3 subrăcire sub linia lichidus, faza solidă se va cristaliza compoziție GA2 Te3. mai degrabă decât GaTe3. Pentru a cristaliza din faza lichidă, s-a eliberat un compus GaTe3 cu punct de topire congruent. compoziția fazei lichide trebuie să se situeze în intervalul de concentrație de la X2 la X3. iar cristalizarea trebuie efectuată la o temperatură în intervalul dintre T3 (
760 K) și T4 (709 K). Cristalizarea unui compus topit incongruent, discutat mai sus, se numește de obicei cristalizarea dintr-o soluție.
Articole similare
Trimiteți-le prietenilor: