Home »Acești diferiți polimeri
A fost un secol de piatră, un secol de bronz, apoi unul de fier. Trăim, desigur, într-o epocă de materiale polimerice. Imaginați-vă că viața noastră fără polimeri este imposibilă - fără materiale plastice, înlocuind lemnul și metalul, fără fibre folosite pentru fabricarea de țesături și frânghii.
Dar ce sunt polimerii? Acestea nu sunt doar molecule foarte lungi, foarte mari. (Hidrocarbonul C80 H162 are o moleculă foarte lungă, dar acest polimer nu este considerat parafină.)
Polimerii aparțin unor astfel de substanțe, ale căror molecule constau în unități repetate, iar numărul acestor legături este mare și nedeterminat. Ce înseamnă vag? Aceasta înseamnă că într-o singură moleculă pot exista trei mii, iar în alta - trei mii cinci sute, în a treia - două mii și jumătate. În medie, numărul de legături în moleculele unui astfel de polimer va fi de aproximativ trei mii.
Polimeri cunoscuți în prezent din abundență. Acestea pot fi împărțite în trei clase: polimeri naturali (derivate din produse naturale), artificiale (adică obținute prin influența unor reagenov chimice asupra polimerilor naturali), și în final, sintetic (derivat dintr-o plantă chimică a substanțelor cu greutate moleculară mică, numite monomeri, moleculele care sunt unități ale lanțurilor polimerice). polimeri naturali și sintetici pot avea aproximativ aceeași structură. Prin urmare, materialele sintetice au adesea proprietăți similare proprietăților polimerilor naturali.
În cadrul fiecăreia dintre aceste clase, polimerii pot fi clasificați în funcție de diferite caracteristici - de exemplu, împărțite în materiale plastice, fibre, filme. Puteți referi materiale la o anumită subsecțiune, în funcție de stabilitate, de exemplu, căldură sau acizi. Aici vom baza clasificarea structurii chimice, vom sorta polimerii cunoscuți în concordanță cu grupurile din care sunt construite lanțurile de polimeri.
Cel mai simplu polimeri de structură. aparținând clasei de așa-numiții compuși cu lanț de carbon - scheletul de lanț al moleculelor compuse din numai atomi de carbon și cele legate numai de hidrogen sau, din nou, cu atomii de carbon. Acestea sunt din polietilenă și polipropilenă.
(Notă caracteristicile formule chimice desemnând polimeri: în paranteză prezintă structura unei legături elementare a lanțului de polimer, iar indicele exprimă repetarea secvențială a acestui grup în molecula de polimer.)
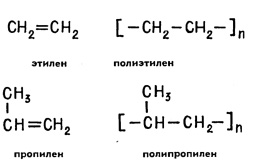
Polietilena este utilizat pe scară largă în viața de zi cu zi - este făcută de film albicios clar, el se duce la producerea de materiale izolatoare pentru dispozitivele wireless, acestea sunt impregnate hârtie absorbantă. Polipropilenă fac din fibre foarte puternic. La temperatura normală, aceste materiale nu sunt solubili în solvenți, dar este de a le cufunda în tetraclorură de carbon sau toluen și temperatura ridicată la 80 ° C, încep să se umfle și apoi se dizolvă.
Polietilena este ușor de distins de alte materiale polimerice. Lipiți o bucată de film de polietilenă în flacăra arzătorului de gaz. Polietilena se topește, se va picura, apoi se va aprinde mai întâi cu o flacără albăstruie și apoi galbenă. În acest caz, mirosi parafina. Acest lucru nu este surprinzător - polietilenă și parafină au aceeași compoziție.
Dacă etilena este unul dintre atomii de hidrogen este înlocuit cu un inel fenil, obține stiren, care este ușor polimerizat în polistiren. Acest polimer este utilizat ca material izolant, este fabricat într-o spumă ușoară. Polistirenul dedurizată atunci când este încălzit deja la 80 ° C. Dacă o bucată de polistiren pentru a aduce flacara sau meciuri, el a aprins repede și va arde flacără fum galben, alocând o pereche cu un miros caracteristic dulce.
Încălziți într-o eprubetă o bucată mică de polistiren pe flacăra arzătorului. Se degajă vapori grei albi - polimerul depolimerizează și se formează stirenul.
Într-un lanț lung de polietilenă, unii atomi de hidrogen pot fi înlocuiți cu atomi de halogen, oxigen, azot și pot obține polimeri cu noi proprietăți valoroase. Dar înlocuirea atomilor naturali în polietilena este o sarcină foarte dificilă, dacă nu chiar imposibilă. Ei o fac într-un mod diferit - înlocuiesc unul sau mai mulți atomi de hidrogen în etilenă și apoi produsul de polimerizare este polimerizat.
Aici este cea mai simplă versiune: înlocuiți în etilen un atom de hidrogen per clor și clorura de vinil rezultată este polimerizată. Ca rezultat, obținem clorură de polivinil, utilizată pe scară largă ca izolator pentru fire electrice.
clorură de polivinil este dizolvat în acetonă, cloroform și acetat de etil, mai preferabil, este solubil în acetonă și benzen. Distinge PVC de la alți polimeri dificili. Calcinează într-un fir de cupru arzător cu gaz, sârmă fierbinte atingeți materialul polimeric necunoscut și umple apoi firul în flacără. În prezența flăcării clor devine verde. Deci ai de a face cu clorură de polivinil (sau copolimer, care este, cu un compus a cărui molecule conțin bucăți lungi de PVC, de exemplu, acetatul de polivinil, polyacrylonitrile). Flacăra arde clorură de polivinil, dar cu dificultate, flacăra are o tentă verzuie.
Produs de polimerizare foarte valoros fluorurat complet etilenă - politetrafluoretilenă, sau cum este adesea numit, teflon. Este un polimer solubil alb, nimic nu se schimbă în timpul răcirii la -100 ° C sau încălzit până la + 250 ° C. Acțiunea clorhidric, sulfuric sau acid azotic nu conduce la distrugerea Teflon. Este utilizat în inginerie electrică și radio, este folosit pentru a face țevi și pompe rezistente chimic, este obținut și fibre. Este ușor să se distingă politetrafluoretilenă în culoarea albă, se simte „grasă“.
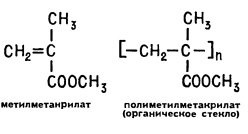
Dacă filmul transparent din polietilenă este privit la o distanță mare, acesta pare tulbure. Dar dacă într-o catenă de polietilenă înlocuiți un hidrogen cu CH3 metil la fiecare al doilea atom de carbon și celălalt cu o grupare esterică COOCH3. vom obține polimerul este foarte transparent. Polimetil metacrilatul este o sticlă organică binecunoscută. Acest polimer este ușor de solubil în acetonă, cloroform, acetat de etil (verificați acest lucru, după ce ați experimentat o bucată mică de sticlă organică).
Notă: până acum am vorbit despre polimeri, a căror moleculă este construită dintr-un lanț lung de atomi de carbon, legată prin legături simple și transportând aceste sau alte grupări. Să ne familiarizăm acum cu polimeri de structură mai complexă.
Tide in vitro sau de jos a sticlei cristaline fenol (este de asemenea numit acid carbolic, luați aproximativ o linguriță) de soluție de formaldehidă în apă (așa-numitul 40 la suta formol, ia-o aproximativ o linguriță). Se agită amestecul și se adaugă la acesta băț câteva picături de acid clorhidric concentrat și apoi se înmoaie imediat tubul în apă rece. (Aici este necesar să se acorde o atenție faptul că toate utilizate în acest experiment, substanța este foarte agresiv, pentru a lucra cu ei trebuie să poarte mănuși de cauciuc, și, în orice caz, nu respirați fumul formol!) După o baie de câteva secunde în tubul de testare băț de lemn sau de sticlă și muta blocat o bucată de lichid vâscos într-un alt tub - cu alcool. Polimerul rezultat este dizolvat în alcool.
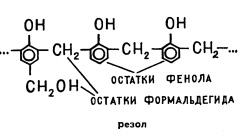
Ce fel de polimer este? Sub influența formaldehidei acid CH2O înlocuiește în atomii de hidrogen fenol, formând lanțuri lungi. Scoateți eprubeta din apa rece și transferați-o într-o tavă cu apă clocotită. După câteva minute, polimerul pe care l-ați luat va deveni greu, trebuie să rupeți eprubeta pentru a îndepărta o bucată de rășină. Încercați să-l dizolvați în alcool - nu se dizolvă. Ce sa întâmplat?
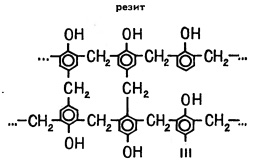
reacția fenolului cu formaldehidă, a mers mai departe, molecula de formaldehidă a început să coase fiecare alte șiruri lungi de rezol și de a obține o resite rețea spațială. Acum, molecula de solvent nu poate lua o singură moleculă de polimer de la un alt fir, pentru că un polimer și nu merge în soluție. Deci, ai o rășină fenol-formaldehidă, care este utilizat pe scară foarte largă pentru fabricarea de materiale electrice de izolare, din plastic, din plastic, butoane și multe alte produse.
Să trecem la polimeri heteroceptori. adică acelea în care firele moleculare, pe lângă atomii de carbon, includ atomi de oxigen, azot și alte elemente. Cei trei polimeri heteroceptori din care sunt fabricați fibrele sunt cunoscuți. Acesta este capron, nailon și lavsan. Primii doi polimeri se bazează pe structura amidică (pentru care prezența grupului - CONH-) este caracteristică. Lovsan este un ester (aici semnul caracteristic este grupul -SO).
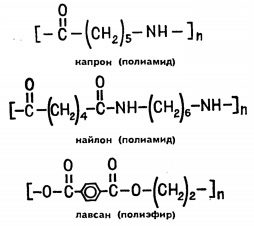
Lipiți o bucată de țesătură din fibre de poliamidă în flacăra arzătorului de gaz. Filamentele se vor topi și vor curge cu picături separate. Acordați atenție mirosului caracteristic neplăcut. După un timp, o masă solidă maronie maronie va rămâne din țesut. Fibra de poliamidă este dizolvată în acid acetic glacial când este încălzită. Fibra de poliester din flacăra arzătorului arde încet cu o flacără galbenă cu fumuri și funingine maro. Spre deosebire de fibra de poliamidă, lavsan nu se dizolvă în acid clorhidric concentrat la fierbere, ci este solubil în acid azotic concentrat prin fierbere. Din aceste motive, puteți recunoaște fibrele.
Polimerii heteroceptivi includ fibrele naturale - lână, mătase, lenjerie și bumbac. Lana și mătasele sunt compuse din proteine (și proteina, așa cum se știe, este alcătuită din aminoacizi). Astfel, atât lâna cât și matasele sunt fibre de poliamidă. Lana contine o proteina keratina, care contine mult sulf. Dar proteinele care alcătuiesc matasele nu conțin sulf. Prin urmare, mătasea este ușor de distins de lână prin miros, dacă aduceți fibra de testare în flacăra unui arzător de gaz. Lana arde cu un miros neplăcut mai pronunțat de păr ars.
Inul și bumbacul, ca hârtia, constau din celuloză. Prin urmare, arde cu mirosul de hârtie arsă. Celuloza este o polizaharidă: de multe ori repetă în inelul său de șase membri molecula cu adaosuri caracteristice tipice pentru soiurile de zahăr.
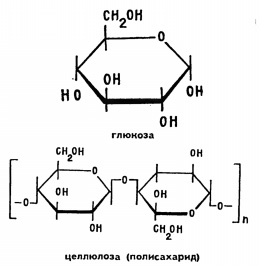
Polizaharidă naturală - vată de bumbac - nu este dificil să tratați chimic, să modificați și să obțineți produse artificiale. Pentru a face acest lucru, în primul rând, într-un pahar, scufundat într-o tavă de apă rece, la acidul azotic concentrat, adăugați cu atenție un acid sulfuric puțin concentrat. Ai un amestec de nitrare. Se amestecă în acest amestec o bucată de vată de mărimea unui nuc pentru 2-3 minute (nu mai mult). Cuplați o bucată de vată de bumbac cu o tijă de sticlă și puneți-o sub robinet de apă de la robinet. După câteva minute, stoarceți vata de bumbac, împrăștiați-o pe o foaie de hârtie blotantă și uscați la aer.
Ce se întâmplă cu celuloza când acționează amestecul de nitratare? Uită-te la formula de celuloză - fiecare legătură cu șase membri poartă trei grupări hidroxil OH. Cu acidul azotic, aceste grupuri formează esterul C-0N02. Prelucrarea celulozei doar 2-3 minute, ați introdus în fiecare inel doar două grupări nitro și ați primit așa numitul dinitrat de celuloză. Cu el puteți efectua experimente interesante. După uscarea dinitratului, dizolvați-l într-un amestec de eter și alcool (aproximativ într-un raport de 2: 1, fiți foarte atent cu eter - este ușor de aprins!). Ați primit o soluție vâscoasă numită collodion și este utilizată pentru sigilarea dopurilor pe sticle cu diferite substanțe. Pentru a face acest lucru, dopul de plută la joncțiunea cu sticla este acoperit cu collodiu și permite evaporarea solventului. Este convenabil să se folosească collodion și să se sigileze răni mici pe piele.
Într-un alt experiment la soluția de camfor în alcool (puteți utiliza alcoolul de camfor vândut în farmacie) adăugați un mic dinitrat de celuloză, umezit cu alcool. Masa rezultată se amestecă bine și se întinde uniform pe o foaie de metal. După un timp, alcoolul se va evapora, lăsând un film numit celuloid.
Azotatul de celuloză este utilizat pentru producerea de filme, lacuri și materiale plastice. În locul acidului azotic, puteți utiliza acid acetic: în acest caz, acetați de celuloză sunt produși care sunt utilizați pentru fabricarea filmului incombustibil, acetat de fibre, adică materiale celulozice artificiale.
Candidat de Științe Chimice G. Shulpin.
Articole similare
-
Care este visul unui accident de avion, interpretarea diferitelor cărți de vis
-
Decorarea camerelor de zi cu tapet pentru o cărămidă în diferite stiluri
-
Pizza cu roșii, cârnați și brânză - rețetă pas cu pas cu fotografie, diverse
Trimiteți-le prietenilor: