Presiunea parțială a gazelor. Presiunea vaporilor de apă
S-au dizolvat în apă sau în țesuturi ale corpului și gazele exercită presiune, deoarece moleculele gazului dizolvat sunt într-o mișcare aleatorie și au energie cinetică. Dacă dizolvat într-un gaz lichid lovește suprafața, de exemplu membrana celulelor, are aceeași presiune parțială ca gaz în amestecul de gaz. Presiunile parțiale ale gazelor dizolvate în apă sunt indicate în același mod ca și presiunile lor parțiale în amestecul gazos, i. Pco2, P02, Pn2, Ph20, PHe etc.
Factori care determină valoarea presiunii parțiale a unui gaz dizolvat într-un lichid. Presiunea parțială a gazului în soluție este determinată nu numai de concentrație, ci și de coeficientul de solubilitate al acestuia, Unele tipuri de molecule, de exemplu dioxid de carbon, sunt atașate fizic sau chimic la moleculele de apă, în timp ce altele - resping. Când moleculele sunt atașate, chiar și un număr mare dintre ele în soluție nu afectează presiunea parțială. În schimb, în cazul moleculelor respingătoare, se observă o presiune parțială mai mare cu un număr mai mic de molecule dizolvate. Aceste relații se numesc legea lui Henry și sunt exprimate prin următoarea formulă:
Presiunea parțială = Concentrația gazului dizolvat / Coeficientul de solubilitate.
Dacă presiunea parțială exprimată în atmosfere (1 atmosferă = 760 mmHg ..), și concentrația - volumul gazului dizolvat în fiecare volum de apă, atunci temperatura corpului important pentru procesul gazelor respiratorii au o solubilitate următoarea coeficienți:
Oxigen 0,024
Dioxid de carbon 0,57
Monoxid de carbon 0,018
Azot 0,012
Heliu 0,008
Este evident că solubilitatea dioxidului de carbon cu mai mult de 20 de ori mai mare decât solubilitatea oxigenului, astfel încât presiunea parțială a dioxidului de carbon (pentru o concentrație dată) este mai mică decât 1/20 presiunii parțiale a oxigenului.
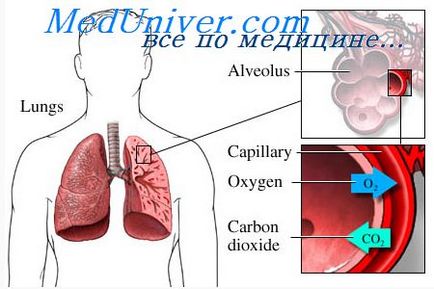
Difuzia gazelor dintre faza gazoasă în alveole și faza dizolvată în sângele capilarelor pulmonare. Presiunea parțială a fiecărui gaz în amestecul de gaze (aer alveolar) determină moleculele acestui gaz să se mute în capilarele alveolare, și acolo să se dizolve în sânge. În același timp, moleculele acestui gaz deja dizolvate în sânge se mișcă liber în partea lichidă a sângelui, iar altele se întorc în alveole. Numărul lor este direct proporțional cu presiunea parțială a acestui gaz în sânge.
Care direcție de difuzie va prevala pentru acest gaz? Direcția predominantă de difuzie este determinată de diferența dintre două presiuni parțiale. Dacă presiunea parțială a gazului asupra fazei gazoase (în aerul alveolar), așa cum se întâmplă de obicei pentru oxigen, numărul mai mare de molecule vor trece în sânge. Dacă presiunea parțială a gazului este mai mare în faza dizolvată a sângelui, care este de obicei valabil pentru dioxidul de carbon, direcția predominantă de difuzie a gazului va fi de ieșire la alveolelor.
Presiunea vaporilor de apă
Când aerul inhalat de pe suprafețele tractului respirator se evaporă imediat și umezește aerul. Acest lucru se datorează faptului că moleculele de apă, precum și moleculele dizolvate de gaze diferite, părăsesc în mod constant stratul de suprafață al apei în faza gazoasă de deasupra. Presiunea parțială, sub influența căreia moleculele de apă părăsește suprafața, se numește presiunea de vapori a apei. La temperatura normală a corpului (37 ° C), presiunea vaporilor de apă este de 47 mm Hg. Art. Prin urmare, atunci când amestecul de gaz este umezit complet, adică când există un echilibru de apă în ambele faze, presiunea parțială a vaporilor de apă în amestecul de gaz este de 47 mm Hg. Art. Ca și alte presiuni parțiale, este desemnat ca РН2O.
Presiunea vaporilor de apă depinde în totalitate de temperatura apei. Cu cât este mai mare temperatura, cu atât este mai mare activitatea cinetică a moleculelor și, în consecință, cu atât este mai mare probabilitatea ca moleculele de apă să părăsească suprafața apei în faza gazoasă. De exemplu, presiunea vaporilor de apă la 0 ° C este de 5 mm Hg. Art. și la 100 ° C - 760 mm Hg. Art. Este important să ne amintim valoarea presiunii vaporilor de apă la temperatura corporală normală - 47 mm Hg. Articolul.; această cantitate va fi menționată în discuții ulterioare.
Articole similare
Trimiteți-le prietenilor: