2.2 Legea lui Pascal.
2.3 Laminar de lichide.
2.4 Legea Poisele.
2.5 Flux turbulent de lichide.
3.1. Măsurarea vâscozității unui lichid.
3.2 Măsurarea volumului fluidului și a debitului
1. Starea lichidă a unei substanțe și a proprietăților sale.
Lichidele ocupă o poziție intermediară între gaze și substanțe solide. La temperaturi apropiate de punctul de fierbere, proprietățile lichidelor se apropie de proprietățile gazelor; la temperaturi apropiate de punctele de topire, proprietățile lichidelor se apropie de proprietățile substanțelor solide. În cazul în care particulele solide caracterizate printr-o ordonare strict inmultire pe distanțe de până la mii de zece raze interatomică sau intermoleculare, materialul lichid este, de obicei nu mai mult de câteva zeci de particule ordonate - acest lucru se datorează faptului că ordonarea particulelor în diferite părți ale substanței lichide la fel de repede, așa cum este din nou "estompată" de vibrația termică a particulelor. Cu toate acestea, în general, densitatea de ambalare a particulelor de substanță lichidă nu este foarte diferit de solid - astfel încât densitatea acestora este aproape de densitatea corpurilor solide și compresibilitatea foarte mici. De exemplu, pentru a reduce volumul ocupat de apa lichidã cu 1%, este necesar sã se aplice presiunea
Sa menționat mai sus că lichidele au un anumit volum intrinsec și iau forma unui vas în care sunt localizate; aceste proprietăți sunt mult mai apropiate de proprietățile unui solid decât de o substanță gazoasă. Așezarea apropiată a stării lichide la starea solidă este confirmată și de datele despre entalpia standard de evaporare ΔH și de entalpia standard de topire ΔH °. Entalpia standard de evaporare este cantitatea de căldură necesară pentru a converti 1 mol de lichid în abur la 1 atm (101,3 kPa). Aceeași cantitate de căldură este eliberată la condensarea a 1 mol de abur în lichid la 1 atm. Cantitatea de căldură consumată în conversia 1 mol din solid în lichid, la 1 atm, numit entalpia standard de topire (aceeași cantitate de căldură eliberată prin „înghețarea“ ( „întărire“) 1 mol dintr-un lichid la 1 atm). Se știe că ΔH ° pl este mult mai mic decât valorile corespunzătoare ΔH °. care este ușor de înțeles, deoarece tranziția de la o stare solidă la o stare lichidă este însoțită de o încălcare mai mică a atracției intermoleculare decât o tranziție de la o stare lichidă la o stare gazoasă.
O serie de alte proprietăți importante ale lichidelor reamintește mai mult de proprietățile gazelor. Deci, ca și gazele, pot curge lichide - aceasta este proprietatea lor numită fluiditate. Rezistența la curgere este determinată de vâscozitate. Fluiditatea și vâscozitatea sunt afectate de forțele de atracție dintre moleculele lichidului, masa lor moleculară relativă și un număr de alți factori. Viscozitatea lichidelor
este de 100 de ori mai mare decât cea a gazelor. Ca și gazele, lichidele pot difuza, deși mult mai lent, deoarece particulele lichidului sunt împachetate mult mai dens decât particulele de gaz.
Una dintre cele mai importante proprietăți ale lichidului este tensiunea superficială (această proprietate nu este inerentă gazelor sau substanțelor solide). Forțele intermoleculare acționează uniform asupra moleculei din lichid din toate părțile. Cu toate acestea, pe suprafața lichidului, echilibrul acestor forțe este încălcat, iar consecința acestor molecule "de suprafață" este sub acțiunea unei forțe rezultante îndreptate către interiorul lichidului. Din acest motiv, suprafața lichidului este în stare de tensiune. Tensiunea de suprafață este forța minimă care împiedică mișcarea particulelor de lichid în adâncimea lichidului și astfel menține suprafața lichidului sub contracție. Tensiunea superficială explică forma de "picătură" a particulelor de fluid care coboară liber.
Datorită conservării volumului, lichidul este capabil să formeze o suprafață liberă. O astfel de suprafață este interfața fazelor substanței: pe o parte este faza lichidă, pe cealaltă parte este gazoasă (vapori) și, eventual, alte gaze, de exemplu aer. Dacă fazele lichide și gazoase ale aceleiași substanțe intră în contact, apar forțe care tind să reducă suprafața - forța de tensionare superficială. Suprafața partiției se comportă ca o membrană elastică, care tinde să se contracte.
Tensiunea superficială poate fi explicată prin atracția dintre moleculele lichidului. Fiecare moleculă atrage alte molecule, tinde să se "înconjoară" cu ele și, prin urmare, să părăsească suprafața. În consecință, suprafața tinde să scadă. Prin urmare, bulele și bulele la fierbere tind să aibă o formă sferică: pentru un volum dat, mingea are o suprafață minimă. Dacă doar forțele de suprafață acționează asupra lichidului, acesta va avea în mod necesar o formă sferică - de exemplu, picături de apă în greutate.
Obiectele mici, cu o densitate mai mare decât densitatea lichidului, pot "pluti" pe suprafața lichidului, deoarece forța gravitațională este mai mică decât forța care împiedică creșterea suprafeței.
Umezirea este un fenomen de suprafață care apare atunci când un lichid intră în contact cu o suprafață solidă în prezența aburului, adică la interfețele cu trei faze. Umezeala caracterizează "adeziunea" lichidului la suprafață și răspândirea peste acesta (sau, invers, repulsia și neacoperirea). Există trei cazuri: non-umectare, udare limitată și udare completă.
Miscibilitatea este capacitatea lichidelor de a se dizolva unul în celălalt. Exemplu de lichide miscibile: apă și alcool etilic, un exemplu de nemiscibil: apă și ulei lichid.
Atunci când două lichide miscibile sunt în vas, moleculele încep să treacă treptat prin interfață ca rezultat al mișcării termice și astfel lichidele se amestecă treptat. Acest fenomen se numește difuzie (apare și în substanțe în alte stări agregate).
Lichidul poate fi încălzit deasupra punctului de fierbere, astfel încât nu se produce fierberea. Aceasta necesită o încălzire uniformă, fără modificări semnificative ale temperaturii în interiorul volumului și fără influențe mecanice, cum ar fi vibrațiile. Dacă arunci ceva într-un lichid supraîncălzit, se fierbe instantaneu. Apa supraîncălzită este ușor de obținut într-un cuptor cu microunde.
Subcolirea - răcirea lichidului sub punctul de îngheț fără a se transforma într-o stare agregată solidă. În ceea ce privește supraîncălzirea, pentru subrăcire, nu este nevoie de vibrații și schimbări semnificative de temperatură.
Dacă suprafața lichidului este deplasată din poziția de echilibru, atunci, sub acțiunea restabilirii forțelor, suprafața începe să se miște înapoi în poziția de echilibru. Această mișcare, totuși, nu se oprește, ci se transformă într-o mișcare oscilantă aproape de poziția de echilibru și se extinde în alte zone. Deci, există valuri pe suprafața lichidului.
Dacă forța de refacere este predominant gravitațională, atunci aceste valuri se numesc valuri gravitaționale. Undele gravitaționale ale apei pot fi văzute pretutindeni.
Dacă forța de refacere este predominant forța de suprafață, atunci aceste valuri sunt denumite capilare. Dacă aceste forțe sunt comparabile, astfel de valuri se numesc valuri capilare-gravitaționale. Valurile de pe suprafața lichidului sunt amortizate de vâscozitate și de alți factori.
În mod formal, pentru coexistența echilibrului unei faze lichide cu alte faze ale aceleiași substanțe - gazoase sau cristaline - sunt necesare condiții strict definite. Astfel, la o presiune dată, este necesară o temperatură strict definită. Cu toate acestea, în natură și în stadiul tehnicii în tot lichidul conviețuiește cu abur sau, de asemenea, cu stare solidă agregat - de exemplu, apă, abur, și de multe ori cu gheață (presupunând o fază de vapori separat prezentă împreună cu aerul). Aceasta se datorează următoarelor motive.
- Starea dezechilibrului. Pentru a evapora lichidul, este nevoie de timp până când lichidul sa evaporat complet, coexistând cu vaporii. În natură, există o evaporare constantă a apei, precum și procesul invers - condensare.
- Volum închis. Lichidul din vasul sigilat începe să se evapore, dar pe măsură ce volumul este limitat, presiunea de vapori crește, devine saturată chiar înainte ca lichidul să se evapore complet, dacă cantitatea sa este suficient de mare. Când se atinge starea de saturație, cantitatea de lichid evaporată este egală cu cantitatea de lichid condensat, sistemul ajunge la echilibru. Astfel, într-un volum limitat, pot fi stabilite condițiile necesare pentru coexistența de echilibru a lichidului și a vaporilor.
- Prezența atmosferei în condiții de gravitate terestră. Lichidul este influențat de presiunea atmosferică (aer și abur), în timp ce pentru abur trebuie luată în considerare numai presiunea parțială. Prin urmare, lichidul și vaporii deasupra suprafeței sale corespund diferitelor puncte ale diagramei de fază, în regiunea existenței fazei lichide, respectiv în regiunea existenței gazoase. Acest lucru nu anulează evaporarea, dar evaporarea necesită un timp în care cele două faze coexistă. Fără această condiție, lichidul se fierbe și se evaporă foarte repede.
2.1 Legea Bernoulli este o consecință a legii conservării energiei pentru un flux constant al unui fluid incompresibil (adică fără frecare internă):
- înălțimea la care se află elementul lichid în cauză,
- presiunea în punctul spațiului în care se află centrul de masă al elementului lichid în cauză,
Accelerarea gravitației.
Constanta din dreapta este de obicei numita cap. sau presiunea totală, precum și integralul Bernoulli. Dimensiunea tuturor termenilor este unitatea de energie per unitate de volum de fluid.
Acest raport, dedus de Daniel Bernoulli în 1738, a fost numit în onoarea sa de către ecuația Bernoulli. Pentru un tub orizontal h = 0 și ecuația Bernoulli ia forma:
.
Această formă a ecuației Bernoulli poate fi obținută prin integrarea ecuației Euler pentru un flux staționar de fluid unidimensional la o densitate constantă ρ:
.
Conform legii Bernoulli, presiunea totală în fluxul constant de lichid rămâne constantă de-a lungul acestui flux.
Presiunea totală constă într-o presiune de greutate (ρgh), statică (p) și dinamică (ρν 2/2).
Din legea Bernoulli rezultă că, pe măsură ce secțiunea de curgere scade, datorită creșterii vitezei, adică a presiunii dinamice, presiunea statică scade. Aceasta este cauza principală a efectului Magnus. Legea Bernoulli este valabilă și pentru fluxurile de gaz laminar. Fenomenul de reducere a presiunii cu creșterea vitezei de curgere este baza pentru funcționarea diferitelor tipuri de debitmetre (de exemplu, conducta Venturi), pompe cu jet de apă și cu jet de abur. Aplicarea consecventă a Actului Bernoulli a dus la apariția unei discipline tehnice hidromecanice - hidraulică.
Legea lui Bernoulli este valabilă în forma sa pură numai pentru lichide a căror vâscozitate este zero, adică lichide care nu aderă la suprafața tubului. De fapt, sa stabilit experimental că viteza unui lichid pe suprafața unui solid este aproape întotdeauna exact egală cu zero (cu excepția detașării jeturilor în anumite condiții rare).
2.2 Legea lui Pascal este formulată după cum urmează:
D
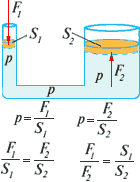
Proprietatea principală a lichidelor și a gazelor - transferul presiunii fără schimbare în toate direcțiile - sta la baza proiectării dispozitivelor și mașinilor hidraulice și pneumatice.
Articole similare
Trimiteți-le prietenilor: