Vom respira aerul, care constă în principal din molecule de azot și oxigen, cu adăugarea nesemnificativă a altor elemente. Astfel, oxigenul este unul dintre cele mai importante elemente chimice. În plus, moleculele sale există într-un număr mare de compuși chimici utilizați în viața de zi cu zi. Pentru a descrie toate proprietățile acestui element, nu există suficiente pagini și o sută, deci ne limităm la principalele fapte din istorie, precum și la caracteristicile elementare ale elementului - valența și gradul de oxidare a oxigenului, gravitatea specifică, aplicarea, proprietățile fizice de bază.
Istoria descoperirii unui element chimic
Oxigen - caracteristici ale structurii moleculei
Acest element chimic este un gaz incolor care nu miros și gust. Formula chimică este O2. Chimistii se refera la oxigenul diatomic convențional fie ca "oxigen atmosferic", fie ca "dioxigen".
Valence și gradul de oxidare a oxigenului
Sub valența unui element chimic, înțelegem capacitatea sa de a atașa la sine un anumit număr de atomi ai altui element chimic. Valența unui atom de oxigen este de două. Valența unei molecule de oxigen este, de asemenea, egală cu două, deoarece doi atomi sunt conectați unul la celălalt și au capacitatea de a atașa la structura lor încă un atom al altui compus, care formează o legătură covalentă cu el. De exemplu, molecula de apă H20 a fost obținută ca rezultat al formării unei legături covalente între un atom de oxigen și doi atomi de hidrogen.
Oxigenul se găsește în mulți dintre compușii chimici cunoscuți. Există chiar și un tip separat de compuși chimici - oxizi. Acestea sunt substanțe obținute prin combinarea aproape oricăror elemente chimice cu oxigen. Gradul de oxidare a oxigenului în oxizi este -2. Cu toate acestea, la anumiți compuși, acest indicator poate fi diferit. Acest lucru va fi descris mai detaliat mai jos.
Proprietățile fizice ale oxigenului
Oxigenul normal diatomic este un gaz care nu are culoare, miros și gust. În starea normală, densitatea sa este de 1,42897 kg / m 3. Greutatea unui litru de substanță este puțin mai mică de 1,5 grame, adică în formă pură, oxigenul este mai greu decât aerul. Când este încălzit, molecula disociază în atomi.

Când temperatura mediului scade la -189,2 ° C, oxigenul își schimbă structura de la gaze la lichid. În același timp, apare fierberea. Pe măsură ce temperatura scade la -218,35 ° C, structura se schimbă de la lichid la cristalin. La această temperatură, oxigenul are forma unor cristale albastre.
La temperatura camerei, oxigenul este slab solubil în apă - un litru din acesta reprezintă 31 mililitri de oxigen. Solubilitate cu alte substanțe: 220 ml pentru 1 litru de etanol, 231 ml pentru 1 litru de acetonă.
Proprietăți chimice ale oxigenului
În combinație cu metalele alcaline active, oxizii formează superoxid sau superexizi. Un exemplu de astfel de formațiuni este:
Particularitatea lor este că gradul de oxidare a oxigenului în superoxid este de -1/2.
În combinație cu cel mai activ element chimic - fluor, se obțin fluoruri. Acestea vor fi descrise mai jos.
Cel mai înalt grad de oxidare a oxigenului în compuși
În funcție de substanța cu care oxigenul interacționează, există șapte grade de oxidare a oxigenului:
- -2 - în oxizi și compuși organici.
- -1 - în peroxizi.
- -1/2 - în superoxid.
- -1/3 - în ozonide anorganice (valabile pentru oxigenul triatomic - ozon).
- +1/2 - în sărurile cationului de oxigen.
- +1 - în monofluorid de oxigen.
- +2 - în difluorid de oxigen.
După cum vedem, cel mai înalt grad de oxidare a oxigenului este obținut în oxizi și compuși organici, iar în fluoruri are chiar un grad pozitiv. Nu toate tipurile de interacțiuni pot fi efectuate în mod natural. Anumiți compuși necesită condiții speciale, de exemplu: presiune înaltă, temperatură înaltă, expunere la compuși rare care aproape nu apar în natură. Să luăm în considerare conexiunile de bază ale oxigenului cu alte elemente chimice: oxizi, peroxizi și fluoruri.
Clasificarea oxizilor prin proprietăți bazate pe acizi
Există patru tipuri de oxizi:
Gradul de oxidare a oxigenului în compușii acestor specii este -2.
- Oxizii de bază sunt compușii cu metale care au un grad redus de oxidare. De obicei, atunci când interacționează cu acizi, se obține sarea corespunzătoare și apa.
- Oxizi de oxizi - oxizi de nemetalici cu un grad ridicat de oxidare. Când se adaugă apă, se formează un acid.
- Oxizii neutri sunt compuși care nu intră în reacție cu acizi sau cu baze.
- Oxizii amfoterici sunt compuși cu metale care au o electronegativitate scăzută. Acestea, în funcție de circumstanțe, prezintă proprietățile oxizilor acizi și bazici.
Peroxizii, gradul de oxidare a oxigenului în peroxidul de hidrogen și alți compuși
Peroxizii sunt compușii oxigenului cu metale alcaline. Ele sunt obținute prin arderea acestor metale în oxigen. Peroxizii compușilor organici sunt extrem de explozivi. Ele pot fi obținute și prin absorbție cu oxizi de oxigen. Exemple de peroxizi:
Toate acestea sunt unite prin faptul că ele conțin grupul de oxigen -O-O-. Ca rezultat, oxidarea oxigenului în peroxizi este -1.

Alte tipuri de peroxizi sunt:
- superexide (superoxiduri, în care oxigenul are o oxidare -1/2);
- anorganice ozonide (compuși extrem de instabili care au un anion de ozon în structura lor);
- Ozonidele organice (compuși având în structura lor legătura -O-O-O).
Fluorurile, gradul de oxidare a oxigenului în OF2
Fluorul este cel mai activ element din toate cele cunoscute în prezent. Prin urmare, interacțiunea dintre oxigen și fluor produce nu oxizi, ci fluoruri. Ele sunt numite astfel deoarece în acest compus nu este oxigen, dar fluor este un oxidant. Fluorurile nu pot fi obținute în mod natural. Ele sunt sintetizate numai, obținând prin asocierea fluorului cu o soluție apoasă de KOH. Fluorurile de oxigen sunt împărțite în:
Să analizăm în detaliu fiecare dintre conexiuni. Oxidul de difluorură este un gaz incolor, cu un miros neplăcut pronunțat. După răcire, se condensează într-un lichid gălbui. În stare lichidă, se amestecă prost cu apă, dar este bine cu aerul, fluorul și ozonul. Conform proprietăților sale chimice, difluorura de oxigen este un oxidant foarte puternic. Gradul de oxidare a oxigenului în OF2 este +1, adică în acest compus, fluorul este un oxidant și oxigenul este un agent reducător. OF2 este foarte toxic, din punct de vedere al toxicității, depășește purul fluor și abordează fosgenul. Utilizarea principală a acestui compus este ca agent de oxidare a combustibilului pentru rachete, deoarece difluorura de oxigen nu este explozivă.
Oxidul de monofluorură în stare normală este un solid gălbui. Când se topește, se formează un lichid roșu. Este un oxidant puternic, este extrem de exploziv când interacționează cu compuși organici. În acest compus, oxigenul prezintă stări de oxidare de +2, adică în acest compus fluor, oxigenul acționează ca agent reducător și fluorul ca oxidant.
Ozonul și compușii săi
Ozonul este o moleculă care are trei atomi de oxigen conectați unul la celălalt. În condiții normale, este un gaz albastru. Când se răcește, se formează un lichid albastru, aproape de indigo. În stare solidă sunt cristale de culoare albastru închis. Ozonul are un miros ascuțit, în natură se simte în aer după o furtună puternică.
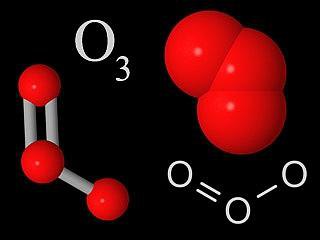
Deoarece ozonul este un oxidant foarte puternic și o cantitate mare de O2 este eliberată în aproape toate procesele care o implică. apoi ozonul este o substanță extrem de toxică. Cu toate acestea, în straturile superioare ale atmosferei, stratul de ozon joacă rolul unui reflector de la radiația ultravioletă a razelor soarelui.
Din ozon, cu ajutorul instrumentelor de laborator, se creează ozonuri organice și anorganice. Acest lucru este foarte instabil în structura materiei, astfel încât crearea lor în condiții naturale este imposibilă. Ozonidele sunt depozitate numai la temperaturi scăzute, deoarece la temperaturi normale sunt extrem de explozive și toxice.
Utilizarea oxigenului și a compușilor săi în industrie
Datorită faptului că la un moment dat, oamenii de știință au învățat, ce grad de oxidare de oxigen în interacțiunea cu alte elemente, ea și compușii săi sunt utilizate pe scară largă în industrie. Mai ales după mijlocul secolului XX au fost inventate expandoare turbo - unități capabile să transforme oxigenul în energie potențială mecanică.

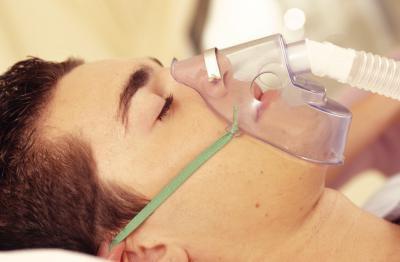
În industria chimică, oxigenul este utilizat ca oxidant al hidrocarburilor în compușii care conțin acid, cum ar fi alcoolii, acizii, etc. În medicină, acesta este utilizat sub presiune redusă pentru a trata pacienții cu probleme pulmonare, pentru a menține funcțiile vitale ale corpului. În agricultură se utilizează doze mici de oxigen pur pentru reproducerea peștilor în iazuri, pentru creșterea proporției de bovine etc.
Oxigenul este un oxidant puternic, fără de care este imposibil să existe
Mai presus de mult a fost scris despre ceea ce oxigenul afișează stările de oxidare atunci când reacționează cu diferiți compuși și elemente, ce fel de compuși de oxigen există, ce fel de pericol și care nu sunt. Unul poate rămâne incomprehensibil - cum, pentru toată toxicitatea și nivelul ridicat de oxidare, oxigenul este unul dintre elementele fără care viața pe Pământ este imposibilă? Faptul este că planeta noastră este un organism foarte echilibrat, care sa adaptat în mod specific la acele substanțe care sunt conținute în stratul atmosferic. Participă la ciclu, care arată astfel: o persoană și toate celelalte animale consumă oxigen și produc dioxid de carbon, iar plantele din marea majoritate consumă dioxid de carbon și produc oxigen. Totul în lume este interconectat, iar pierderea unei legături în acest lanț poate duce la ruperea întregului lanț. Nu trebuie să uităm de acest lucru și să avem grijă de viața de pe planetă în întregime și nu numai de reprezentanții săi individuali.


10 fapte interesante despre intimitate, despre care probabil că nu știați. Consultați cele mai interesante și impresionante date despre activitatea sexuală care vă vor surprinde.

Ce se întâmplă cu corpul unei persoane care nu face sex? Sexul are aproape aceeași nevoie de bază, ca și consumul de alimente. Cel puțin, după ce ați început să vă ocupați de ele, nu vă veți opri. Chiar dacă țineți.

Articole similare
Trimiteți-le prietenilor: