Informații generale despre fluorura oxigenului și starea de oxidare în OF2
oxigen Fluorul în condiții normale este o lumină de gaz galben (aproape incolor), rezistent la lumină și se descompune la încălzire (structură moleculară prezentată în Fig. 1).
Formula brută este OF2. Masa molară este de 54 g / mol. Punctul de topire este -223,8 ° C, punctul de fierbere este -144,8 ° C.
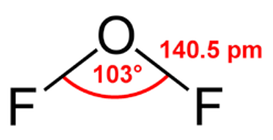
Fig. 1. Structura moleculei de fluor oxigen, indicând unghiul de valență și lungimea legăturii chimice.
În stare lichidă, se dizolvă bine aerul. Destul de solubil în apă rece, reacționând încet cu el. Este un agent puternic de oxidare.
OF2, gradul de oxidare a elementelor din acesta
Pentru a determina gradul de oxidare a elementelor care alcătuiesc fluorura de oxigen, trebuie în primul rând să înțelegem la ce elemente este cunoscută această cantitate.
Fluorul prezintă un grad constant de oxidare întotdeauna egal cu (-1). Pentru a găsi gradul de oxidare cu oxigen va avea valoarea ei pentru „x“ și definiți cu ecuația electroneutralității:
Aceasta înseamnă gradul de oxidare a oxigenului în fluorură de oxigen (+2):
Exemple de rezolvare a problemelor
Elementul central are gradul maxim de oxidare în compusul hidroxi:
Pentru a găsi răspunsul corect la întrebarea adresată, vom verifica alternativ fiecare dintre opțiunile propuse.
a) Atomul central este clorul. Luăm valoarea gradului de oxidare a clorului pentru "x" și compunem ecuația de electroneutralitate. Gradul de oxidare a oxigenului și a hidrogenului este egal cu (-2) și respectiv (+1).
1 + (-2) + x + 2 (-2) = 0;
b) Atomul central este fosforul. Luăm valoarea gradului de oxidare a fosforului pentru "y" și compunem ecuația de electroneutralitate. Gradul de oxidare a oxigenului și a hidrogenului este egal cu (-2) și respectiv (+1).
3 × 1 + 3 × (-2) + y + (-2) = 0;
c) Atomul central este sulful. Luăm valoarea gradului de oxidare a sulfului pentru "z" și compunem ecuația de electroneutralitate. Gradul de oxidare a oxigenului și a hidrogenului este egal cu (-2) și respectiv (+1).
2 × 1 + 2 × (-2) + z + 2 × (-2) = 0;
d) Atomul central este fosfor. Luăm valoarea gradului de oxidare a fosforului pentru "a" și compunem ecuația de electroneutralitate. Gradul de oxidare a oxigenului și a hidrogenului este egal cu (-2) și respectiv (+1).
3 × 1 + 3 × (-2) + a = 0;
Cea mai mică valoare a gradului de oxidare este (+3), este caracteristică pentru fosfor în compusul cu compoziția (HO) 3P
Articole similare
Trimiteți-le prietenilor: