10.3.2. Transportul oxigenului prin sânge
Doar o mică parte din O2 (aproximativ 2%), transportată prin sânge, este dizolvată în plasmă. Cea mai mare parte a acesteia este transportată sub formă de compus fragil cu hemoglobină, care la nivelul vertebratelor este conținut în celulele roșii din sânge. Moleculele acestui pigment respirator includ o proteină specifică speciilor, globină și un grup protetic, o hemă care conține fier feros, construită similar în toate animalele (Figura 10.27).
Adăugarea de oxigen la hemoglobină (oxigenarea hemoglobinei) are loc fără o schimbare a valenței fierului, adică fără transferul de electroni care caracterizează oxidarea adevărată. Cu toate acestea, hemoglobina, asociată cu oxigenul, se numește de obicei oxidat (mai corect - oxihemoglobină) și care a eliberat oxigen (mai corect - deoxigeoglobină).
1 g de hemoglobină poate lega 1,36 ml de O2 gazos (la presiune atmosferică normală). Luând în considerare, de exemplu, că în sângele uman există aproximativ 150 g / l de hemoglobină, 100 ml de sânge poate transporta circa 21 ml de O2. Aceasta este așa-numita capacitate de oxigen a sângelui. Oxigenarea hemoglobinei (cu alte cuvinte, procentul prin care se folosește capacitatea de oxigen a sângelui) depinde de presiunea parțială 02 în mediul cu care sângele intră în contact. Această dependență este descrisă de curba de disociere a oxihemoglobinei (Figura 10.28). Forma complexă în formă de S a acestei curbe este explicată prin efectul de cooperare al patru lanțuri polipeptidice de hemoglobină, ale căror proprietăți de legare la oxigen (afinitate pentru O2) sunt diferite.
Datorită acestor caracteristici de sânge venos trece capilare pulmonare (alveolar P O 2 cade pe partea superioară a curbei), oxigenați aproape complet, iar sângele arterial în capilare de țesuturi (unde Po2 corespunde cea mai abruptă parte a curbei) dă efectiv O2. Cele cu eliberare de oxigen, să contribuie
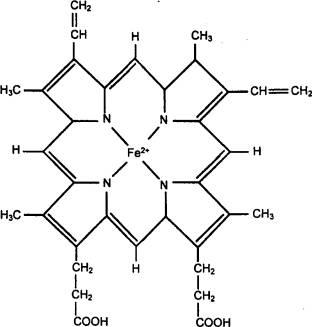
Fig. 10.27 Structura moleculei hemice
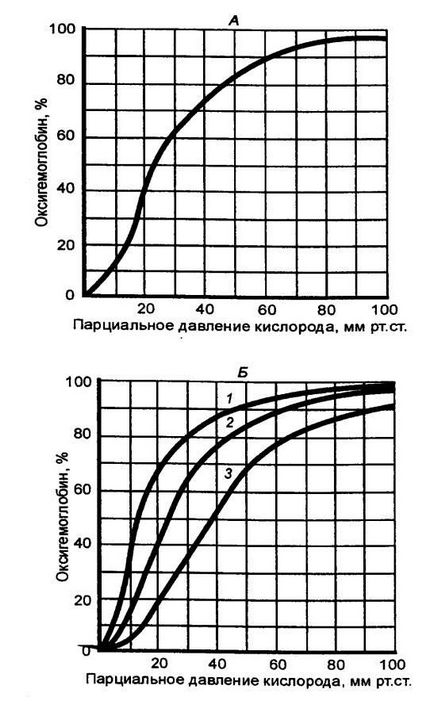
Fig. 10.28 Curbele de disociere pentru oxihemoglobin
A - curba de saturare a hemoglobinei cu oxigen la un conținut normal de CO2. B - efectul schimbării tensiunii de CO2 pe curba de disociere a oxihemoglobinei; 1 - cu un conținut scăzut de CO2. 2 - norma, 3 - cu un conținut ridicat de C02.
2,3-difosfogliceratul conținut în eritrocite, a cărui sinteză este mărită de hipoxie și intensificarea procesului de oxidare în țesuturi.
Curba de disociere a oxihemoglobinei se deplasează spre dreapta cu creșterea temperaturii și cu o creștere a concentrației de ioni de hidrogen în mediu, care, la rândul său, depinde de Pco2 (efectul Verigo-Bohr). Prin urmare, sunt create condiții pentru o distribuție mai completă a oxigenului de către oxihemoglobină în țesuturi, în special acolo unde rata metabolică este mai mare, de exemplu, în mușchii de lucru. Totuși, chiar și în sângele venos, o parte mare sau mică (de la 40 la 70%) de hemoglobină rămâne în formă oxigenată. Astfel, la fiecare 100 ml de sânge se administrează la țesuturi 5-6 ml de O2 (așa-numita diferență arterio-venoasă în oxigen) și, natural, este îmbogățit cu oxigen în plămâni cu aceeași cantitate.
Afinitatea hemoglobinei pentru valoarea oxigenului măsurată a presiunii parțiale de oxigen la care hemoglobina este saturată 50% (P50) la om, este în mod normal, aproximativ 26,5 mm Hg. Art. pentru sângele arterial. P50 Parametru reflectă capacitatea pigmenților respiratorii se leaga de oxigen. Acest parametru este mai mare pentru animalele de hemoglobină găsit în mediu slab de oxigen, precum și pentru așa-numita hemoglobinei fetale, care se gaseste in sange fetal primeste oxigen de la mama sange prin placenta.
Articole similare
Trimiteți-le prietenilor: