Obiectivele lecției:
- Introduceți conceptul de cantitate de materie și unitățile sale de măsurare: mol, mmol, kmol.
- Oferă o idee despre Avogadro constant.
- Arătați relația dintre masă, cantitatea de materie și numărul de particule.
Obiectivele lecției:
- 1. Să contribuie la formarea concepțiilor lumii ale elevilor privind interconectarea diferitelor proprietăți ale fenomenelor din lumea înconjurătoare.
- 2. Dezvoltarea capacității elevilor de a stabili relațiile cauze-efect, precum și de a observa, generaliza și trage concluzii.
Termeni de bază:
- Non-metalele sunt elemente chimice care formează într-o formă liberă substanțe simple care nu posedă proprietățile fizice ale metalelor.
- mole este cantitatea de orice substanță care conține cât mai multe elemente structurale ca și atomii în 12g. carbon-12 nuclid
Cantitatea de substanță
În chimie (și, de asemenea în fizică și alte științe naturale) trebuie să se confrunte cu un număr mare de particule minuscule - așa-numitele elemente materiale structurale (molecule, atomi, ioni, electroni, etc ...).
Pentru a exprima numărul acestor particule, am introdus o unitate de cantitate - o molie. 1 mol este cantitatea de substanță care conține cât mai multe elemente structurale ca și atomii în 12 g. carbon nuclid-12. Experimental a constatat că numărul de elemente structurale care corespunde la 1 mol, egal cu 6,02 ∙ 1023 (postoyannuyu6,02 ∙ 1,023 mol-1 se numește Avogadro Cilindri constant. Cu substanțe în 1 mol).

Fig. 1. Constant Avogadro
Ilustrație a consecințelor legii lui Avogadro
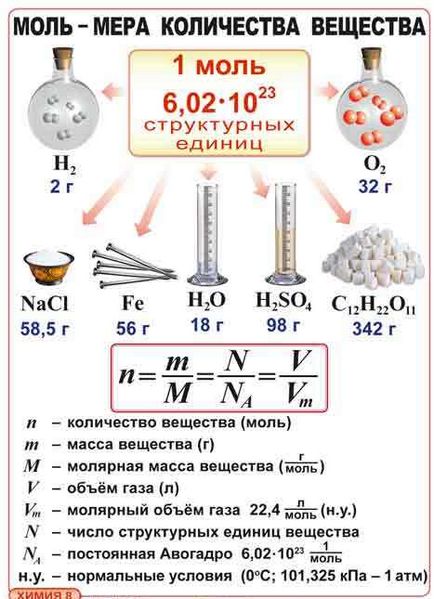
Fig. 2. Mole este o unitate de cantitate de substanță
Mole este o unitate de cantitate de substanță

Fig. 3. Cantitatea de substanță
Această parte a substanței are o masă, numită masa molară. M este notat cu M = m / n. Să presupunem în ce unități se măsoară masa molară?
masa molara coincide semnificativ cu greutatea atomică sau moleculară relativă dar diferă în unitățile (M - g / mol, Mr, Ar - cantități adimensionale).
Fig. 4. Cantitatea de substanță în mol

Fig. 5. Masa molară
Unitate de control
№1.
Masa de 3 moli de H2O este ____ g
Masa de 20 moli de H2O este ____ g
№2.
36 g de H2O este ______ mol
180 g H2O este _______ mol
• Câte molecule sunt conținute în 180 g de apă?
• Găsiți masa de 24x1023 molecule de ozon?
Este interesant să știți ce.
Oxigenul este cel mai frecvent element chimic din scoarța pământului. Oxigenul face parte din aproape toate substanțele din jurul nostru. De exemplu, apa, nisipul, multe roci și minerale care alcătuiesc crusta pământului conțin oxigen. Oxigenul este, de asemenea, o parte importantă a multor compuși organici, de exemplu, proteine, grăsimi și carbohidrați, care au o importanță excepțională în viața plantelor, a animalelor și a oamenilor.
În 1772 chimistul suedez K.V. Scheele a stabilit că aerul constă din oxigen și azot. În 1774, Priestley a obținut oxigen prin descompunerea oxidului de mercur (2). Oxigen - gaz incolor, inodor și insipid, relativ puțin solubil în apă, puțin mai greu decât aerul 1 l de oxigen în condiții normale cântărește 1,43 g și 1 L de aer - 1,29 g (condiții normale - prescurtat: y n. - temperatura 0 ° C și presiunea 760 mm Hg sau 1 atm). La o presiune de 760 mm Hg. Art. și temperatura - 183 оС oxigen este lichefiat, iar când temperatura scade la -218,8 оС se întărește.
Elementul chimic oxigen O, cu excepția oxigenului obișnuit O2. există sub forma unei alte substanțe simple - ozonul O3. Oxigenul O2 este transformat în ozon într-un instrument numit ozonizor.
Este un gaz cu un miros caracteristic ascuțit (denumirea "ozon" în greacă - "miros"). Probabil ați simțit mirosul de ozon în timpul unei furtuni. Ozonul constă din trei atomi ai unui element de oxigen. Ozonul pur este un gaz albastru, de 1 ori și jumătate mai greu decât oxigenul, este mai bine dizolvat în apă.
În atmosfera aerului de deasupra Pământului la o altitudine de 25 km există un strat de ozon. Acolo, ozonul este format din oxigen sub influența radiației ultraviolete de la soare. La rândul său, stratul de ozon întârzie această radiație, care este periculoasă pentru toate lucrurile vii, ceea ce asigură o viață normală pe Pământ.
Ozonul este utilizat pentru dezinfectarea apei potabile, deoarece ozonul oxidează impuritățile nocive în apă naturală. În medicină, ozonul este folosit ca dezinfectant.
Referințe
Editat și trimis la Borisenko I.N.
Deasupra lecției lucrate:
Yakovleva L.A.
Borisenko I.N.
Puteți pune întrebarea despre educația modernă, puteți exprima o idee sau puteți rezolva o problemă urgentă la Forumul Educațional. unde la nivel internațional se adună un consiliu educațional de gândire și acțiune proaspătă. Prin crearea unui blog, va spori nu numai statutul său ca un instructor calificat, dar, de asemenea, aduce o contribuție semnificativă la dezvoltarea școlii viitoare. Liderii Alianței Educație își deschide porțile pentru profesioniștii din cel mai înalt rang, și invită să coopereze pentru crearea celor mai bune școli din lume.
Articole similare
Trimiteți-le prietenilor: