Masa moleculară a acidului clorhidric gazos
Acidul clorhidric (acid clorhidric, acid clorhidric) este o substanță complexă de natură anorganică care poate exista atât în stare lichidă, cât și în stare gazoasă.
În cel de-al doilea caz, este un gaz incolor, foarte solubil în apă, iar în primul - o soluție de acid tare (35-36%). Structura moleculei de acid clorhidric, precum și formula sa structurală, sunt prezentate în Fig. 1. Densitatea este de 1,6391 g / l (nu). Punctul de topire este - (-114,0 ° C), fierbere - (-85,05 ° C).
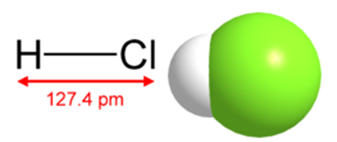
Fig. 1. Formula structurală și structura spațială a moleculei de acid clorhidric.
Formula brută de acid clorhidric este HCI. După cum se știe, greutatea moleculară a moleculei este suma maselor relative atomice ale atomilor cuprinzând molecula (valorile masei atomice relative luate din Mendeleev Tabelul periodic sunt rotunjite la întregi).
Mr (HCI) = Ar (H) + Ar (CI);
Mr (HCI) = 1 + 35,5 = 36,5.
Masa moleculară (M) este masa de 1 mol de substanță. Este ușor să se arate că valorile numerice ale masei moleculare M și ale masei moleculare relative sunt egale, dar prima cantitate are dimensiunea [M] = r / mol, iar a doua dimensiune este fără dimensiuni:
Aceasta înseamnă că masa molară de acid clorhidric este de 36,5 g / mol.
Masa molară a substanței în stare gazoasă poate fi determinată utilizând conceptul volumului său molar. În acest scop, se constată volumul ocupat în condiții normale de o anumită masă a unei substanțe date și apoi se calculează în aceleași condiții o masă de 22,4 litri din această substanță.
Pentru a atinge acest obiectiv (calculul masei moleculare), este posibilă utilizarea ecuației de stare a unui gaz ideal (ecuația lui Mendeleev-Clapeyron):
unde p - Presiune gaz (Pa), V - volumul de gaz (m 3), m - masa substanței (g), M - masa molară a materialului (g / mol) T - temperatura absolută (K), R - este constanta universală a gazelor egală cu 8,314 J / (mol x K).
Exemple de rezolvare a problemelor
În care dintre substanțele de mai sus, fracțiunea de masă a elementului oxigen este mai mare: a) în oxid de zinc (ZnO); b) în oxid de magneziu (MgO)
Fracțiunea de masă a elementului X din molecula compoziției HX se calculează după următoarea formulă:
ω (X) = nx Ar (X) / M (HX) x 100%.
Calculam fracția de masă a fiecărui element de oxigen în fiecare dintre compușii propuși (valorile masei atomice relative luate din tabelul periodic al DI Mendeleyev sunt rotunjite la întregi).
Să găsim greutatea moleculară a oxidului de zinc:
Mr (ZnO) = Ar (Zn) + Ar (O);
Domnul (ZnO) = 65 + 16 = 81.
Se știe că M = Mr, deci M (ZnO) = 81 g / mol. Apoi fracția de masă a oxigenului din oxidul de zinc va fi:
ω (O) = Ar (0) / M (ZnO) x 100%;
ω (O) = 16/81 x 100% = 19,75%.
Să găsim greutatea moleculară a oxidului de magneziu:
Mr (MgO) = Ar (Mg) + Ar (O);
Mr (MgO) = 24 + 16 = 40.
Se știe că M = Mr, prin urmare M (MgO) = 60 g / mol. Apoi fracția de masă a oxigenului din oxidul de magneziu va fi:
ω (O) = Ar (O) / M (MgO) x 100%;
ω (O) = 16/40 x 100% = 40%.
Astfel, fracția de masă a oxigenului este mai mare în oxidul de magneziu, de la 40> 19,75.
Fracțiunea de masă a elementului X din molecula compoziției HX se calculează după următoarea formulă:
ω (X) = nx Ar (X) / M (HX) x 100%.
Calculam fracția de masă a fiecărui element de oxigen în fiecare dintre compușii propuși (valorile masei atomice relative luate din tabelul periodic al DI Mendeleyev sunt rotunjite la întregi).
Să găsim greutatea moleculară a oxidului de aluminiu:
Mr (Al2O3) = 2 × 27 + 3 × 16 = 54 + 48 = 102.
Se știe că M = Mr, prin urmare M (Al2O3) = 102 g / mol. Apoi fracția de masă din aluminiu în oxid va fi:
ω (Al) = 2 x Ar (Al) / M (AI2O3) x 100%;
ω (Al) = 2 x 27/102 x 100% = 54/102 x 100% = 52,94%.
Să găsim greutatea moleculară a oxidului de fier (III):
Domnul (Fe2O3) = 2 × 56 + 3 × 16 = 112 + 48 = 160.
Se știe că M = Mr, prin urmare M (Fe2O3) = 160 g / mol. Apoi fracția de masă a fierului în oxid va fi:
ω (O) = 3 x Ar (O) / M (Fe2O3) x 100%;
ω (O) = 3 x 16/160 x 100% = 48/160 x 100% = 30%.
Astfel, fracția de masă a metalului este mai mare în oxidul de aluminiu, deoarece 52,94> 30.
Articole similare
Trimiteți-le prietenilor: