
Acasă | Despre noi | feedback-ul
Conductivitatea electrică specifică depinde de mulți factori. Acest lucru nu permite obținerea unor rezultate comparabile și reproductibile. Prin urmare, este mai bine să se folosească o conductivitate electrică echivalentă, la 1kg-eq de materie.
Să găsim relația dintre specificul (# 967;) și conductivitatea electrică echivalentă (# 955;). Imaginați-vă un vas mare prismatic cu o bază pătrată de 1 m 2. doi pereți din care sunt electrozi de platină (Pt) și doi pereți sunt din sticlă. Se toarnă electrolitul în vas la o înălțime de 1 m, în timp ce conductivitatea electrică totală va fi egală cu conductivitatea specifică. W = # 967;
Creșterea volumului soluției, obținem: W = 2 # 967 ;;
și, în final, W = V × # 967;
unde V este volumul soluției care conține 1 kg-echivalent de electrolit.
În acest caz, conductivitatea electrică totală este egală cu conductivitatea electrică echivalentă: W = # 955; v.
Și apoi: # 955; v = Vx # 967; (6)
Conductibilitatea electrică echivalentă este conductivitatea unei coloane a unei soluții care conține 1kg-eq de electrolit închis între electrozi distanțați la o distanță de 1m.
Numărul de m 3 al soluției în care este conținută 1 kg-eq din substanța dizolvată se numește diluție a soluției.
Dimensiunea conductivității electrice echivalente ( # 955; v): [cm x m 2 kg-eq -1], [cm x m 2 x kg-eq -1]
Diluarea este inversul concentrației:
În sistemul SI: [cm × m 2 × kg-eq -1]
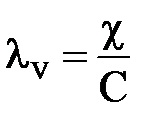
În sistemul GHS: [cm × cm 2 × g-eq -1]
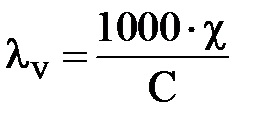
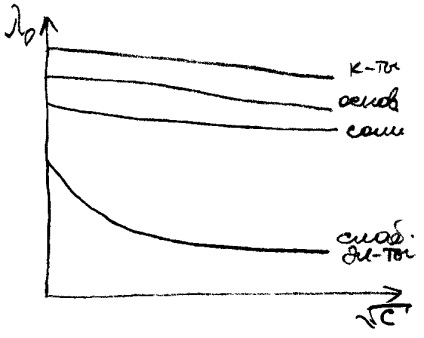
Când se diluează soluția, conductivitatea electrică echivalentă poate crește, deoarece, atunci când este diluată, crește gradul de disociere și la atingerea # 945; = 1, diluția suplimentară nu mai poate mări disocierea și conductivitatea electrică echivalentă rămâne constantă, adică are tendința de a limita valoarea (l∞) (vezi figura 4).
Valoarea limită a conductivității electrice echivalente pentru gradul de disociere # 945; = 1 se numește conductivitatea electrică echivalentă pentru diluția infinită.
Raportul determină proporția moleculelor disociate.
Pentru electroliți puternici, această cantitate se numește coeficientul de conductivitate electrică și se determină prin formula:
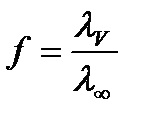
Și pentru electroliții slabi - gradul de disociere și calculat de formula
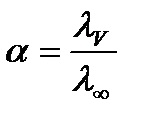
Conductivitatea electrică echivalentă la diluția infinită (l∞) este calculată în conformitate cu legea lui Kohlrausch:
Conductibilitatea electrică echivalentă a ionilor la diluția infinită este tabulară. Pentru o soluție de electroliți puternici, l∞ se găsește în program :. Se constată prin extrapolarea graficului la o diluție mare.
Datorită efectului electrostatic al ionilor unul asupra celuilalt, concentrația efectivă în soluție este mai mică decât cea calculată, iar măsura abaterii este gradul de disociere sau coeficientul de conductivitate electrică.
Disocierea electroliților slabi este un proces reversibil. La orice temperatură într-o soluție a unui electrolit slab există cationi, anioni și molecule.
Să luăm în considerare disocierea unui electrolit slab prin exemplul acidului acetic:
Determinăm constanta de disociere din formula:
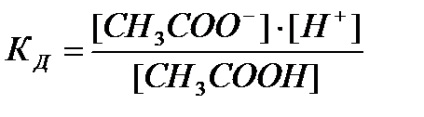
Să presupunem că în V ml de soluție conține un mol de acid acetic (CH3COOH), atunci concentrația inițială de acid acetic este:
Denumim prin x numărul de moli de CH3COOH care se dezintegrează în ioni, atunci numărul de ioni va fi:
.
Numărul de molecule nedisociate este definit ca:
prin urmare, constanta de echilibru este egală cu:
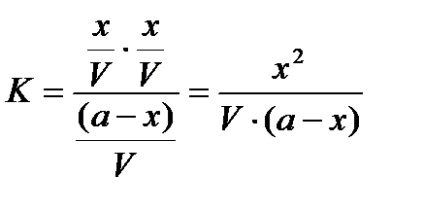
Indicați "X" cu "a". . atunci:
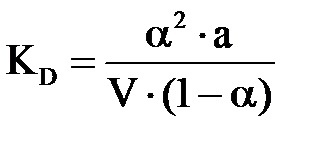
Având în vedere acest lucru

Pentru electroliții slabi ← 0, atunci numitorul este aproximativ egal cu 1, iar forma simplificată a legii de reproducere Ostwald va arăta astfel:
Kd = a 2 x C (11)
Găsim gradul de disociere de la aceasta:
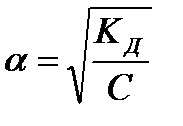
Gradul de disociere variază invers cu rădăcina pătrată a concentrației. Astfel, cu o scădere a concentrației cu un factor de 100, gradul de disociere va crește cu un factor de 10.

Articole similare
Trimiteți-le prietenilor: