- 6.1. Efectele termice ale reacțiilor chimice
Ключові терміни:
6.1. Efectele termice ale reacțiilor chimice
Termochimic secțiune numită termodinamicii chimice, care se referă la aplicarea primei legi pentru a calcula efectele termice ale diferitelor procese fizico-chimice. Reacțiile chimice, fază de tranziție, procesele de cristalizare, dizolvare etc. Pentru practica de cel mai mare interes au calculele termochimice efectele termice ale reacțiilor chimice.
Entalpia standard de formare este cantitatea de căldură care este eliberată (reacție exotermă) sau absorbită (reacție endotermă), reacția ireversibilă are loc numai atunci când lucrarea este doar lucrarea de expansiune.
În consecință, pentru reacțiile chimice, raportul dintre prima lege a termodinamicii
- [TEX] \ delta = dU + PdV [/ TEX], (6.1)
- aici [TEX] Q [/ TEX] este efectul termic al reacției chimice,
- [TEX] \ delta = PdV [/ TEX] este lucrarea efectuată de sistem în timpul reacției.
Efectul termic al unei reacții chimice care se desfășoară la un volum constant se numește efectul de căldură isochoric și este notat cu [TEX] Q_ [/ TEX]. Deoarece în acest caz [TEX] PdV = 0 [/ TEX], atunci
În consecință, efectul termic al unei reacții chimice care are loc la un volum constant este egală cu schimbarea energiei interne a sistemului.
Efectul termic izobaric al reacției [TEX] \ stânga (Q_\ right) [/ TEX] poate fi găsit prin integrarea ecuației (6.1):
Efectul termic izobaric al reacției chimice este egal cu schimbarea entalpiei sistemului.
Astfel, efectele termice isocorice și izobarice sunt egale cu modificările funcțiilor de stat. În consecință, ele nu depind de calea procesului, ci sunt determinate numai de stările inițiale și finale ale sistemului. Independența efectelor termice ale reacțiilor din calea lor a fost stabilită de academicianul rus GI. Hess în 1840, pe baza datelor experimentale.
Legea lui Hessian
Legea lui Hess stabilește că, dacă din substanța sursă dată este posibil să se obțină în diferite moduri produsele finale specificate, atunci indiferent de modul de obținere, și anume, din numărul și tipul reacțiilor intermediare, efectul termic total pentru toate căile va fi același.
Cu alte cuvinte, efectul termic al reacției chimice depinde numai de tipul și starea materiilor prime și a produselor de reacție și nu depinde de calea tranziției.
Să clarificăm sensul exemplului legii lui Hess. Deoarece cele mai multe ori reacțiile chimice apar la presiune constantă, efectul lor termic va fi caracterizat de o schimbare a entalpiei [TEX] \ Delta [/ TEX]. Imaginați-vă procesul de transformare a substanțelor inițiale [TEX] A _ [/ TEX], [TEX] A _ [/ TEX], [TEX] A _ [/ TEX]. în produse, [TEX] B _ [/ TEX], [TEX] B _ [/ TEX], [TEX] B _ [/ TEX]. și această transformare poate fi realizată în diferite moduri:
- Reacția directă a transformării substanțelor A în substanțe B cu efect termic [TEX] \ Delta> [/ TEX].
- O reacție constând din două etape cu efecte termice [TEX] \ Delta> [/ TEX] și [TEX] \ Delta> [/ TEX].
- Un set de reacții cu efecte termice [TEX] \ Delta> [/ TEX], [TEX] \ Delta> [/ TEX], [TEX] \ Delta> [/ TEX], [TEX] \ Delta> [/ TEX].
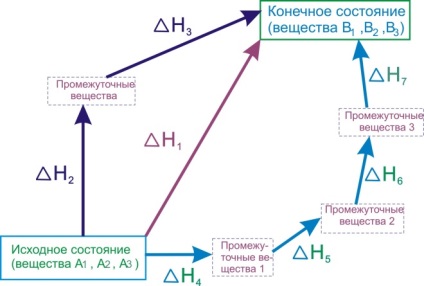
Figura 6.1 - Ilustrația Legii lui Hess
Legea lui Hess afirmă că aceste efecte termice sunt legate de relația:
Semnificația practică a legii Hess este că ne permite să calculam efectele termice ale unor astfel de reacții pentru care nu pot fi măsurate direct. De exemplu, efectul termic [TEX] \ Delta H_ [/ TEX] reacție [TEX] C + 1/2 O_ = CO [/ TEX] nu poate fi determinată prin măsurarea directă, ca simultan cu această reacție, există întotdeauna o formațiune de reacție [TEX] CO_ [/ TEX]. Pentru a determina [TEX] \ Delta> [/ TEX], folosim efectele termice ale următoarelor reacții:În conformitate cu legea lui Hess
Efectele termice ale reacțiilor chimice pot fi măsurate și efectuate experimental în instrumente speciale numite calorimetre. Măsurătorile calorimetrice precise necesită mult timp și consumă mult timp. Prin urmare, acestea se desfășoară numai dacă este imposibil să se folosească legea lui Hess.
La scrierea ecuațiilor termochimice de reacție se indică starea agregată a reactivilor și efectul termic al reacției:
O astfel de intrare indică faptul că reacția 1 mol de acetonă gazos [TEX] C_H_O [/ TEX] cu 4 moli de gaz de oxigen se obțin 3 moli de gaz [TEX] CO _ [/ TEX] si 3 mol de apă lichidă. Astfel, la 1 mol de acetonă se eliberează 1817,0 kJ de căldură.
Deoarece efectele termice depind de starea fizică a reactanților și condițiile în care are loc reacția, apoi pentru calcule termochimice, efectele termice introduse în ecuația termochimic, ar trebui să fie atribuită un fel de aceleași condiții, altfel ele nu sunt comparabile. Pentru astfel de condiții, se iau condițiile în care se produce reacția între substanțe în stări standard.
Pentru starea standard a substanțelor lichide și solide individuale, se iau starea lor stabilă la o temperatură de 298,15 K ([TEX] 25<^>C, [/ TEX]) și presiuni de 101325 Pa, iar pentru gaze - o stare a lor atunci când, la o presiune de 101325 Pa și o temperatură de 298,15 K, se supun ecuației de stare a unui gaz ideal. Prin urmare, efectele termice ale reacțiilor în condiții standard sunt notate cu [TEX] \ Delta_ ^ 0 [/ TEX] și [TEX] \ Delta_ ^ 0 [/ TEX].Din legea lui Hess urmează consecințe care au o mare semnificație practică.
Trimiteți-le prietenilor: