Funcția principală a lipoproteinelor este transportul lipidelor în organism.
Există următoarele clase de lipoproteine:
-lipoproteine sau HDL, cu electroforeză pe hârtie, migrează împreună cu α-globuline. HDL este bogat în proteine și fosfolipide.
-lipoproteinele sau LDL, corespund mobilității beta-globulinelor. Sunt bogate în colesterol.
Pre-lipoproteinele sau VLDL sunt localizate pe lipoproteinograma între a-lipoproteine. Principala formă de transport a trigliceridelor endogene.
Chilomicronii - cu electroforeza pe hârtie nu se mișcă nici la catod, nici la anod, rămânând la început. Chilomicronii sunt principala formă de transport a trigliceridelor exogene.
Cu un număr de boli, spectrul de lipoproteine al modificărilor serice ale sângelui. Au existat 5 tipuri de anomalii ale spectrului de lipoproteine.
Tipul IV - hiper pre-lipoproteinemie. Creșterea nivelului VLDL, N-LDL, absența XM. Nivel crescut de TG cu colesterol normal sau ușor crescut. Se combină clinic cu diabetul zaharat, obezitatea, boala cardiacă ischemică.
Tipul V - hiper-pre-lipoproteinemie sau chylomicronemia. Nivelul de VLDL este în creștere, prezența de XM. Clinic xanthomaz, uneori combinat cu diabetul latent.
Cromoproteinele sunt proteine complexe constând din proteine și componenta ne-proteică colorată asociată. Numele a venit din cuvântul grecesc chroma - vopsea.
Cromoproteinele sunt împărțite în 3 grupe:
1. Hemoproteine - conțin ca fier protetic un grup de fier.
2. Magneziu - porfirine.
3. Flavoproteinele - conțin derivați de izoaloxazină.
Grupul de hemoproteine include hemoglobina și derivații acesteia, mioglobina și enzimele - sistemul citocrom, catalaza și peroxidaza.
Toate cromoproteinele conțin proteine care sunt diferite în compoziție și structură. Componenta non-proteică are o similaritate structurală.
În molecula hemoglobinei, componenta proteică este reprezentată de proteina globină, componenta non-proteică este heme.
Globin constă din 4 subunități 2 și 2. Fiecare catenă conține 141 reziduuri de aminoacizi și - 146.
În fiecare subunitate există un "buzunar" hidrofob în care este localizată hema.
Hem este o moleculă plană care conține 4 inele de pirol și un atom de fier asociat cu ele:
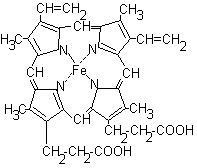
Hem se conectează cu partea proteică (globină) cu legături hidrofobe între inelele de pirol și radicalii de aminoacizi hidrofobi. Între atomul de fier și inelul imidazol al unuia dintre resturile histidină din globină există o legătură de coordonare. Datorită unei alte legături de coordonare cu atomul de fier, o moleculă de oxigen poate fi atașată pentru a forma oximhemoglobină.
Inelele de pirol ale hemei sunt situate în același plan, iar atomul de fier iese din acest plan. Adăugarea de oxigen "îndreaptă" molecula hemei: fier se deplasează în planul inelelor de pirol și aceasta determină o schimbare în conformația proteinei. În molecula de hemoglobină există 4 protomeri, fiecare dintre care conține heme și poate atașa oxigenul. Adăugarea primei molecule de oxigen modifică conformația protonului. Modificarea conformării unui proton modifică conformația protomerilor rămași. Schimbarea în conformația protonilor facilitează atașarea moleculelor de oxigen rămase. Acest fenomen se numește acțiune de cooperare. Afinitatea hemoglobinei pentru a patra moleculă de O2 este de aproximativ 300 de ori mai mare decât în prima moleculă.
Aceasta constă în legarea și transferul de oxigen din plămâni în țesuturi. Hemoglobina, legată de oxigen, se numește oxihemoglobină.
Articole similare
Trimiteți-le prietenilor: