
Acasă | Despre noi | feedback-ul
Oxizii de azot joacă un rol-cheie în formarea "smogului" fotochimic (a se vedea lecția relevantă), afectează distrugerea stratului de ozon (vezi prelegerea relevantă). Datorită acestei circumstanțe, poluarea atmosferică cu oxizi de azot exercită atât efecte locale, cât și globale asupra stării mediului.
Poluarea atmosferică cu oxizi de azot este, în general, relativ redusă. Cu toate acestea, în zonele cu o industrie chimică dezvoltată, în special în vecinătatea fabricilor de producere a acidului azotic, există zone locale cu conținut ridicat de NO, NO2 în aer.
Compușii azotați din troposferă sunt în principal reprezentați de oxizi de azot, amoniac și săruri de amoniu, precum și acid azotic și nitrați. Dintre oxizii de azot, trebuie izolat oxidul de azot (N2O), monoxidul (NO) și dioxidul de azot (NO2). Alți compuși de azot cu oxigen (N03, N2O3, N2O4, N2O5) sunt instabili în condiții troposferice. De exemplu, trioxidul de diazotiu și tetroxidul de azot se descompun cu ușurință pentru a forma NO și NO2:
Trioxidul de azot suferă rapid o fotodissociare sau interacționează cu alte impurități:
Pentoxidul diazotenei este de asemenea instabil în troposferă de compus și se descompune pentru a forma trioxid de diazotină și oxigen sau sub influența umidității se transformă în acid azotic:
Prin urmare, formula generală a oxizilor de azot NOx înseamnă în mod uzual NO, N02 și N2O.
Principalele procese de îndepărtare a N2O din atmosferă sunt asociate cu procesul de fotodisocializare:
sau cu interacțiunea cu un atom de oxigen excitat de singlet:
N2 0 + 0 (1 D) 2NO
Ultimele două reacții au loc la aproximativ aceeași rată. Având în vedere că concentrația atomilor de oxigen excitate individual în troposferă este scăzută și că practic nu există radiații cu o lungime de undă de 250 nm, moleculele de N2O au o durată lungă de viață și se pot muta în stratosfera. În stratosfera, pe măsură ce concentrația atomilor 0 (1 D) crește și spectrul radiațiilor solare transmise se schimbă, rata de distrugere a moleculelor de N2O crește brusc. Prin urmare, concentrația de N2O la o altitudine de 35 km este de aproximativ 10 ori mai mică decât în troposferă.
Principalele surse naturale de oxizi de azot (procesele de denitrificare, oxidarea NH3, precum și oxidarea azotului în descărcările de trăsnet) furnizează anual de la sol la troposferă de la 21 până la 89 de milioane de tone de NOx în ceea ce privește azotul elementar. În plus, ca urmare a emisiilor antropice, circa 20 de milioane de tone de azot sub formă de oxizi sunt eliberate în atmosferă. Atât emisiile naturale cât și cele antropice conțin în principal NO.
Una dintre principalele surse de formare a oxidului de azot este oxidarea azotului de aer, care însoțește toate procesele de combustie în care aerul este folosit ca oxidant. Odată cu creșterea temperaturii, cantitatea de echilibru de oxid de azot din aer crește. Procesele de ardere a combustibililor fosili în centralele termice și combustibilul ars în motoarele auto sunt principalele surse de poluare atmosferică cu oxizi de azot.
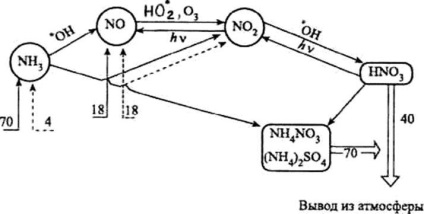
Ciclul atmosferic al compușilor de azot (număr - milioane tone de azot elementar pe an):
® - intrările naturale ale compușilor de azot;
---® - intrările antropice ale compușilor de azot;
Þ - retragerea din atmosferă
În troposferă, NO, interacționând cu radicalul hidroperoxid, devine dioxid de azot:
O altă modalitate posibilă de oxidare a oxidului nitric este interacțiunea cu ozonul:
Dioxid de azot în troposferă în prezența radiației cu lungimea de undă l <398 нм разлагается с образованием оксида азота и атома кислорода:
Monoxidul de azot rezultat este din nou supus procesului de oxidare, iar oxigenul atomic conduce la apariția ozonului în troposferă.
O parte importantă a ciclului atmosferic al compușilor de azot (vezi Fig.) Este formarea acidului azotic. Aproximativ 44% din acidul azotic din troposferă se formează ca urmare a interacțiunii dioxidului de azot cu un radical hidroxilic:
Aproximativ 24% din HNO3 apare în atmosferă ca urmare a interacțiunii pentoxidului diazotan cu moleculele de H2O conform ecuației (1). Până la 28% din acidul azotic total eliberat în atmosferă se formează prin interacțiunea trioxidului de azot cu radicalii organici care conțin oxigen.
O parte din acidul azotic se descompune pentru a forma dioxid sau trioxid de azot, care sunt din nou incluse în ciclul atmosferic al compușilor de azot (vezi Fig.):
Spre deosebire de acidul sulfuric, acidul azotic poate rămâne în atmosferă pentru o lungă perioadă de timp în stare gazoasă, deoarece condensează prost. Vaporii acidului azotic sunt absorbiți în atmosferă prin picături de nori sau particule de aerosol.
Cantitatea principală de acid azotic derivă din troposferă cu precipitații atmosferice sub formă de soluții de HN03 și sărurile sale.
Amoniacul joacă un rol important în procesele atmosferice care implică compuși de azot. În soluția apoasă, amoniacul are o reacție alcalină, care poate neutraliza compușii acizi atmosferici:
Aceste reacții chimice conduc la formarea de sulfat de amoniu și nitrat.
Cea mai importantă sursă de amoniac atmosferic este solul. Substanțele organice din sol sunt sensibile la distrugerea microbiologică. Amoniacul este unul dintre produsele de distrugere a substanțelor organice. Mai ales o cantitate mare de amoniac este eliberată în timpul descompunerii urinei de la animale domestice. De exemplu, în Europa, această sursă este și mai semnificativă decât eliberarea amoniacului din sol. O sursă importantă este și producerea și aplicarea îngrășămintelor azotate în sol. Fluxul de amoniac în atmosferă ca urmare a arderii cărbunelui sau combustibilului este nesemnificativ.
Anual, din surse naturale, aproximativ 70 milioane de tone de NH3 intră în atmosferă în ceea ce privește azotul. Contribuția antropică la poluarea atmosferică prin amoniac este de numai aproximativ 4 milioane de tone.
Cu precipitații atmosferice și ca urmare a proceselor de depunere uscată, aproximativ 70 milioane de tone de compuși de amoniu sunt îndepărtați anual din atmosferă. O parte din amoniac (de la 3 la 8 milioane de tone pe an) interacționează cu radicalii liberi, în principal cu un radical hidroxilic:
În viitor · NH2 este ușor oxidat la monoxid de azot.
Articole similare
Trimiteți-le prietenilor: