O caracteristică importantă termodinamic a sistemului XYZ este energiyaU său interior - energie haotic (caldura Vågå) Sisteme de mișcare microparticule (molecule, atomi, electroni, nucleare, etc ...) și energia de interacțiune a particulelor. Din această definiție rezultă că energia internă nu include energia cinetică a mișcării sistemului ca întreg și energia potențială a sistemului în câmpurile exterioare.
energie internă - o funcție de starea termodinamică a sistemului, și anume, în fiecare stat, sistemul are o energie internă bine definită (aceasta nu depinde de modul în care sistemul a ajuns la acea stare) ... Asta este
înseamnă că atunci când un sistem se schimbă de la o stare la alta, schimbarea energiei interne este determinată numai de diferența dintre valorile energiei interne a acestor stări și nu depinde de calea tranziției. În § 1 am introdus noțiunea de număr de grade de libertate - numărul de variabile independente (coordonate) care determină complet poziția sistemului în spațiu. Într-o serie de probleme, molecula unui gaz monatomic (figura 77, a) este considerată ca un punct material, la care trei
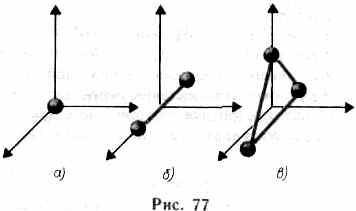
gradul de libertate a mișcării translaționale. Energia mișcării de rotație poate fi ignorată (r-> 0, J = mr 2 ® 0, Tvp = Jw 2 / 2®0).
In mecanica clasica molecula de gaz diatomica într-o primă aproximație, este considerată ca o combinație a două puncte de material legat rigid de legătură deformabilă (fig. 77 b). Acest sistem, pe lângă cele trei grade de libertate a mișcării progresive, are două grade de libertate de mișcare rotativă. Rotirea în jurul celei de-a treia axe (axa care trece prin ambii atomi) nu are sens. Astfel, un gaz diatomic are cinci grade de libertate (i = 5). Moleculele neliniare cu trei atomi (Figura 77,0) și polatomice au șase grade de libertate: trei de translație și trei de rotație. Firește, nu există o legătură rigidă între atomi. Prin urmare, pentru moleculele reale, este de asemenea necesar să se țină seama de gradele de libertate a mișcării oscilante.
Indiferent de numărul total de grade de libertate a moleculelor, cele trei grade de libertate sunt întotdeauna translaționale. Niciunul dintre gradele graduale de libertate nu are un avantaj față de celelalte, astfel încât fiecare dintre ele are în medie o energie identică egală cu 1/3 din valoarea În derivarea mecanică statistică clasică a Boltzmann privind distribuția uniformă nominală a energiei a gradelor de libertate a moleculelor: pentru sistemul statistic într-o stare de echilibru termo-dinamic, fiecare în stupatelnuyu și grade de rotație de libertate au o energie cinetică medie-lic ravnayakT / 2 , și pentru fiecare grad vibrațional de libertate - în mediu, energia egală cu kT. gradul vibrațională „posedă“ de două ori-Ener Gia, deoarece aceasta reprezintă nu numai energia cinetică (ca în LES ceai-translație și de rotație de mișcare-zheny), dar, de asemenea, potențialul, valorile medii-set ale energiilor cinetice și potențiale sunt identice. Astfel, energia medie a unei molecule unde i este suma numărului de translațional, numărul de numere rotaționale și dublate ale gradelor vibraționale de libertate ale unei molecule: În teoria clasică, sunt luate în considerare molecule cu o legătură rigidă între atomi; pentru ei coincid cu numărul de grade de libertate a moleculei. Deoarece energia potențială reciprocă a gazului ideal pentru a moleculelor este bine-lu (interacțiune moleculară între un non-există), energia internă, Nye referire la un mol de gaz este suma energiilor cinetice ale moleculelor NA: Energia internă pentru o masă arbitrară m de gaz unde M este masa molară, v este cantitatea substanței. Prima lege a termodinamicii Q = U2-U1 + A; cu o schimbare infinitezimală în starea sistemului: unde - o cantitate infinitezimală de căldură transferată în sistem - lucrările efectuate de sistem față de sistemul extern. forțele, DU - schimbați-l intern. energie. Descrierea sistemelor de profil kbe (kbe), standard, energie, expert Funcțiile matematice în sql (modulul numeric, rotunjirea, exponentierea, calculul rădăcinilor și
Ecuația (1) este definiția dU. t. și - valorile măsurate independent. P. n. Astfel, dU este diferența totală a unei anumite funcții U (cantitățile u, în general, nu sunt diferențe complete). Astfel. orice termodinamică. sistemul posedă o energie energetică de stat U. Depinde numai de parametrii care determină starea de echilibru a sistemului și este independent de procesul la care a fost adus sistemul în această stare. Căldura transmisă Q și lucrul A depind de calea prin care se efectuează procesul, deoarece cantitățile și nu sunt diferențe complete.
Articole similare
Trimiteți-le prietenilor: