Ribosomi liberi și consistenți: ingestia de proteine în EPS
Ribosomi "liberi" și "sessile" Editați
Transmiterea transportului în EPR Edit
Proteinele de transport efectuate în RES ca sinteza lor, ca ribozom sintetizarea proteinelor cu secvența semnal la EPR, „stau“ pe complexele specifice asupra EPR membranei translocare.
Secvența semnal pentru EPR include în mod tipic 5 până la 10 aminoacizi predominant hidrofobi și este localizată la capătul N-terminal al proteinei. La sfârșitul său îndepărtat, există o secvență de consens recunoscută de o protează specifică. Această secvență semnal este identificată de un complex special - "particula de recunoaștere a semnalului" (SRP). SRP constă din șase proteine și o moleculă de ARN scurtă.
Un sit SRP leagă secvența de semnal, iar celelalte linkuri către ribozom și blochează traducerea. Un domeniu SRP separat este responsabil pentru legarea la receptorul SRP pe membrana EPR.
Împreună cu ribosome SRP se mută la și comunică cu receptorilor SRP (proteine integrale) EPR pe partea citosolică a membranei EPR. Acest complex (receptorul ribozom - SRP - SRP) se leagă uneori de un translocator de proteine pe membrana EPR. În mod tipic, mai multe ribozomi sunt atașați la ARNm, iar poliribozomii stau pe membrana EPR, fiecare ribozom atașat la porii săi. Atingerea capătul 3 'al ARNm, ribozomi revine la citoplasma, ARNm dar este păstrat la membrana ESR, datorită faptului că noul ribozom tricotate cu SRP, atașată la 5'-end.
După legarea la complexul de translocator SRP - receptor SRP este separat de ribozomului, iar acest lucru duce la o reluare a difuzat. Este acum dovedit că traducerea proteine EPR pătrunde prin translocator canal de apă având un mecanism de suprimare a fasciculului în eucariotele și format din patru subunități complexe Sec61 (proteine omoloage au asupra membranelor celulare bacteriene).
După reluarea translației, porțiunea hidrofobă a secvenței semnal rămâne legată de translocator, iar proteina nou sintetizată este împinsă în EPR printr-o buclă. Acest proces nu necesită cheltuieli suplimentare de energie ATP. După ce C-terminalul proteinei este separat de ribozom și este în interiorul EPR, proteaza peptidei semnal se taie din proteină. Proteinele din ESR este minimizat prin achiziționarea conformației normală, în timp ce peptida semnal printr-un canal lateral deschis în translocator este deplasat în EPR membrană lipidică bistratificată unde proteazele rapid distruse.
Prins in EPR este o proteină din organelle, dacă există un „holding în EPR» (ER-reținere) o secvență de patru aminoacizi la capătul C-terminal. Unele dintre proteinele EPR rămase joacă un rol important în plierea și modificarea post-translațională a proteinelor care trec prin EPR. Astfel, izomeraza enzima bisulfura catalizeaza oxidarea libere SH-grupe de cisteină și formarea de legături disulfurice în proteine Chaperone BiP previne misfolding și agregarea proteinelor pentru a forma structuri de cuaternare, precum și promovează retenția proteinelor legate de ESR.
Embedding de proteine în membranele EPR
Un mecanism similar, dar mai complex, asigură integrarea cotranslațională a proteinelor transmembranare în membrana EPR.
Transportul post-translațional în EPR Edit
Există, de asemenea, o posttranlyatsionny proteina de transport in EPR (mai frecvente în drojdie), în care proteina complet sintetizat se leagă cu chaperones în citosol și apoi transferat în EPR prin translocator care implică familia Hsp70 chaperones. Acest mod de transport este dependent de ATP. Pentru peptidele de transport (lungime preferabil 8-16 aminoacizi) din citosol EPR pentru prezentarea ulterioară în complex cu moleculele MHC-I are un translocator special - TAP-proteină.
Transportul proteinelor din EPS la aparatul Golgi Edit
Proteinele provin din EPR în AH din interiorul veziculelor cu membrană frontală, a cărui membrană este formată din proteina COP-II. Toate proteinele pliate corect intră în astfel de bule "în mod implicit" și se mută în AG, iar apoi unele dintre ele se întorc la EPR. Cu toate acestea, proteinele cu etichete speciale de semnal se concentrează în veziculele de transport, iar proteinele fără astfel de etichete ajung acolo într-o cantitate mică. EPR separate de bule, cochilii defavorizate îmbinare în clustere tubulare veziculare care prin intermediul unui motor de proteine se deplasează de-a lungul microtubuli la AG. Din aceste grupuri (ca de cis-Golgi) separate bule imbracate de proteine COP-I, pentru a furniza o proteină de transport retur rezident în EPR. Întoarcere proteinele din EPR este furnizată o secvență semnal scurt la capătul lor C-terminal, care se leagă fie direct COP-I (pentru proteinele de membrana), sau la un receptor specific, care interacționează cu COP-I (pentru proteine solubile). Proteinele lipsite de aceste secvențe rămân preponderent în AH.
În interiorul veziculelor, proteinele trec treptat de la cis-Golgi la trans-Golgi. Pe măsură ce proteinele se deplasează în AG, enzimele glicoziltransferazei își modifică "etichetele" oligozaharidelor. Cu ajutorul enzimelor similare, sinteza glicoproteinelor - mucinelor și proteoglicanilor - are loc în AH.
Funcția principală a aparatului Golgi este sortarea proteinelor
Transportul proteinelor către lizozomi
Transportul proteinelor de la AH la lizozomi
Proteinele de membrană de lizozomi și enzime digestive provin din trans-Golgi compus mărginite bule clathrin în endozomul timpurie, și de acolo - la Lizozom. Pentru a introduce enzimele lizozomale (hidrolaze acide) în lizozomi ei trebuie prisutsvovvat marcaj special - reziduuri capete manoză-6-fosfat ale lanțurilor oligozaharidice. Această etichetă se aplică în două etape. În primul rând, în enzima cis-Golgi N-atsetilglyukozaminfosfotransferaza atașează la oligozaharide resturile N-atsetilglyukozaminfosfata, și apoi, în trans-Golgi scindează doua enzimă N-acetilglucozamină. Eticheta se aplică acelor proteine care au trăsături specifice ale structurii terțiare - un plasture de semnal. Apoi, 6-fosfații de manoză sunt recunoscuți de un receptor specific al membranei, la care sunt atașați hidrolaze. PH-ul endozomilor este redus hidrolază separat de receptori care în bule speciale livrate înapoi și hipertensiune.
Mutațiile genei rezultat N-atsetilglyukozaminfosfotransferazy de mucopolysaccharidosis severe - boala I-celulă, în cazul în care toate enzimele lizozomale sunt secretate în mediul extracelular.
Transportul proteinelor din mediul în lizozomi
Chiar și în partea normală a enzimelor lizozomale eliberate din celule, ca parte a proteinelor de membrană lizozomale cade pe membrana sale exterioare. Din extracelular enzimele lizozomale mediu pot fi absorbite prin endocitoză și transportat la Lizozom (vezi [2].).
Transportul proteinelor din citoplasmă în lizozomi
În plus față de transportul vezicular din AH, există un alt mod de a transporta proteinele la lizozomi. Astfel, în transportul autophagy direcționat mediat chaperone produce proteine parțial denaturate din citoplasmă prin membrana Lizozom în cavitatea sa, în cazul în care acestea sunt digerate. Acest tip de autofagie, descris numai pentru mamifere, este indus de stres. Aceasta are loc cu participarea proteinelor chaperone citoplasmice HSP-70 familie, proteine auxiliare si LAMP 2, care este un complex receptor de membrană și proteina chaperone să fie de transport in Lizozom. Celulele prezentatoare de antigen (de exemplu, celule dendritice) prezentiruemyh de transport peptidic complexați cu MHC-II, se pot produce direct prin lizozomi-translocator proteina TAPL.
Transportul proteinelor în nucleul celular și din nucleu
Proteinele intră în nucleu prin porii nucleari. Prin timpul nuclear, până la 500 de macromolecule pot fi transportate simultan în ambele direcții. Proteinele (peptide) cu greutate moleculară de până la 5.000 de Daltoni difuzați liber prin porii nucleari (astfel încât concentrația acestora în citoplasmă și în nucleu să fie aceeași). Transportul pasiv (difuzie) prin porii poate pătrunde în proteine cu o greutate moleculară de până la 60.000 daltoni.
De la proteine mai mari la nucleu având includ numai secvența semnal pentru miez (una sau două porțiuni scurte de proteine, bogat în resturi de aminoacizi încărcate pozitiv - arginină sau lizină). lega proteine specifice cu această secvență - receptori importați în nucleu (uneori cu proteine adaptor suplimentare). Importatorii de receptori din nucleu sunt, de asemenea, asociați cu componente ale porilor viguroși. Acesta oferă energie pentru hidroliza GTP transport, transportate mici Elementele de bază ale GTPase monomerice - RAN proteine. RAN-proteina citoplasmatică este legată de forma PIB, atât în citoplasmă localizate proteinele GAP-Ran (proteine activatori activitate GTPase Ran), în nucleul de proteine Ran este legat la forma GTP, ca în miez localizat proteine, care asigură schimbul de GDF pe GTP. legarea la interiorul porilor, cu o viguroasă „încărcată“ receptor de import la nucleul-Ran GTP, asigură trecerea sa în nucleu și descărcare. Apoi, cu receptorul ieșirile Ran-GTP atașate în citoplasmă unde proteina GAP-GTP produce receptor import hidroliză și separarea RAN PIB în nucleu.
Un mecanism similar asigură exportul de proteine din nucleu, numai aceste proteine trebuie să aibă o secvență semnal diferită, care leagă receptorii de export din nucleu (proteine similare structurii cu receptorii de import).
Această problemă este discutată mai detaliat în secțiunea Porții Nucleare
Transportul proteinelor din aparatul Golgi către membrana exterioară
Proteinele care sunt încorporate în membrana EPS și provin de acolo ca o parte a veziculelor din AH se pot muta în membrana exterioară a celulei. Direcția lor spre membrană se datorează interacțiunii veziculelor cu microtubuli ai citoscheletului și datorită proteinelor speciale de andocare care asigură fuziunea veziculelor cu membrana.
Funcția secretorie a aparatului Golgi Edit
Endocitoză: fagocitoză și pinocitoză
[1] - Animarea pinocitozei (pe baza exempluului de absorbție a colesterolului în celula LDL) (text în limba engleză)
Exocitoza și transcitoza Editați
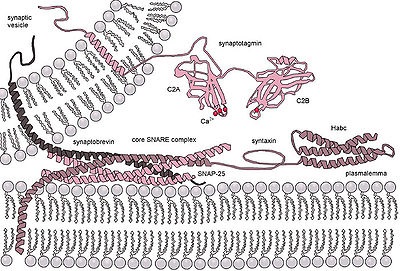
Moleculară de eliberare exocitotică a neurotransmițătorului în sinapse. Complexul SNARE este format prin formarea unei legături cu patru catenuri între synaptobrevin. sintaxa și SNAP-25. Synaptotagmin servește ca un senzor de calciu și un regulator intern al formării unui complex proteic
Exocitoza este atât în eucariote cât și în procariote. Exocitoza (din Έξω greacă. - Exterior si κύτος - celula) in eucariote - proces celular in care veziculele intracelulare (vezicule de membrana) fuzioneze cu membrana externă a celulei. Când conținutul de exocitoza veziculelor secretor (bule ekzotsitoznyh) excretata și siguranțele lor membrane filtrante cu membrana celulară. Practic, toți compușii macromoleculați (proteine, hormoni peptidici etc.) sunt izolați din celulele eucariote în acest fel.
La procariote mecanismul exocitoza veziculară nu este găsit, ele sunt numite exocitoza încastrarea proteinelor din membrana celulară (sau la membrana externă a bacteriilor gram-negative), separarea proteinelor din celulele în mediu sau în spațiul periplasmic [1].
Exocitoza poate efectua diverse sarcini:
- furnizarea la membrana celulară a lipidelor necesare creșterii celulare;
- Livrarea în membrană a proteinelor membranare. cum ar fi receptorii sau proteinele de transport. În același timp, o parte din proteina care a fost direcționată în vezicula secretoare pare să fie proeminentă pe suprafața exterioară a celulei;
- izolarea diferitelor substanțe din celulă; acesta poate fi, de exemplu, alimente nedigerate în protists fagotrofnyh, enzime digestive la animale cu digestia cavitar, proteine substanță intercelulară la animale și materialul peretelui celular in plante, molecule de semnalizare (hormoni sau neurotransmițători).
În eucariote, există două tipuri de exocitoză:
- Exocitoza constitutivă independentă de calciu apare în aproape toate celulele eucariote. Acesta este un proces necesar pentru construirea unei matrice extracelulare și transmiterea de proteine către membrana celulară exterioară. În acest caz, veziculele secretoare sunt livrate pe suprafața celulară și fuzionează cu membrana exterioară în momentul în care se formează.
- Calcium dependentă nekonstitutivny exocitoza are loc, de exemplu, în w chimice: sinapse sau celule care produc hormoni macromoleculare și servește, de exemplu, pentru izolarea neurotransmitatori. Cu acest tip de exocitoza de vezicule secretorii se acumulează în celulă, iar procesul de eliberare a acestora este declanșată de o creștere rapidă a semnalului specific mediat în concentrația ionilor de calciu în citoplasmă celulei. Procesul membranei presinaptice realizată de o proteină dependentă de calciu deosebit de complex [w: [SNARE |]].
Digestia intracelulară Editați
Mecanismul digestiei intracelulare Edit href = Edit
Rolul digestiei intracelulare pentru animale Edit href = Edit
Autofagia, rolul său Edit
Autophagy (din vechea αὐτός greacă -. În sine și φαγεῖν - «este»), «samopozhiranie“ - un proces prin care componentele celulare sunt livrate în ea și suferă o degradare lizozomală în ele.
Acum se disting trei tipuri de autofagie: microautofagia, macroautofagia și autofagia dependentă de chaperon.
Când mikroautofagii ca și în formarea organelor multivehiculari formate cu membrana endosomii invaginare sau lizozomi care sunt apoi separate în formă de vezicule interne, ele cad numai substanțele sintetizate în celula în sine. În acest fel, celula poate digera proteine atunci când există o lipsă de energie sau material de construcție (de exemplu, în timpul foametei). Dar procesele de microautofagie au loc în condiții normale și sunt, în general, neselective. Uneori, organoizii sunt digerați în timpul microautofagiei; astfel încât în drojdii este descrisă peroxisomes mikroautofagiya și miezuri mikroautofagiya parțiale, în care celulele rămân viabile.
Când regiunea citoplasmatică macroautophagy (adesea cuprinzând orice organite) care înconjoară compartimentele cu membrană, cum ar fi rezervor reticulului endoplasmic. Ca rezultat, această regiune este separată de restul citoplasmei de două membrane. Astfel de organele cu două membrane care înconjoară organele îndepărtate și citoplasma sunt numite autofagozomi. Autofagozomii se combină cu lizozomii. formând autofagolizomi, în care sunt digerate organele și restul conținutului de autofagozomi.
Se pare, de asemenea, macroautophagy fără discernământ, deși este adesea subliniat faptul că prin intermediul ei celula poate scapa de „supradozare“ organite (mitocondrii. Ribozomii, etc.).
Al treilea tip de autofagie este mediată de chaperone. In acest proces, transportul direcționat are loc proteine parțial denaturate din citoplasmă prin membrana Lizozom în cavitatea sa, în cazul în care acestea sunt digerate. Acest tip de autofagie, descris numai pentru mamifere, este indus de stres. Aceasta se întâmplă cu participarea proteinelor chaperone citoplasmatice ale familiei hsc-70, a proteinelor auxiliare și LAMP-2. care servește ca receptor de membrană a complexului chaperon și a proteinei care trebuie transportată la lizozom.
În tipul autofagic de moarte celulară, toate organele celulare sunt digerate, lăsând doar reziduuri celulare. absorbită de macrofage.
Patologia care încalcă digestia intracelulară Edit href = Edit
Celule și substanță intercelulară Edit href = Edit
Formarea și compoziția substanței intercelulare Edit href = Edit
Interacțiunile celulelor cu substanța intercelulară
Articole similare
Trimiteți-le prietenilor: