Majoritatea articolelor de pe site sunt dedicate explicării modului în care proteinele sunt transferate prin membrana reticulului endoplasmatic (EPR). Acest lucru se datorează în principal faptului că funcția de transport EPR a fost studiată cel mai bine. Principalul mod de translocare a proteinelor secretoare a fost studiat în detaliu. Totuși, aspectele legate de translocarea substraturilor mai complexe rămân neexplorate, în special în ceea ce privește integrarea proteinelor membranare.
Cum sunt orientate domeniile transmembranare și ce determină integrarea lor în membrană? Care este rolul interacțiunii dintre domeniile TM care are loc înainte de integrarea lor? Odată cu aceasta, devine clar că translocarea este un proces reglementat în care eficiența poziționării, transportului și integrării proteinelor, precum și factorii necesari pentru aceasta, depind în mod semnificativ de substrat și de condițiile în care este localizată celula. Deși nu înțelegem modul în care este reglementată translocarea și modul în care celula realizează acest proces în conformitate cu solicitările sale.
Deși structura canalului de translocație a fost clarificată acum, metoda mobilizării și mecanismul portal al transloconului sunt încă în curs de investigare. Cum recunoaște secvența de semnal care conduce la schimbări structurale în canal? Structura canalului are flexibilitatea de a reorienta lanțul transferat sau de a asigura acumularea mai multor domenii transmembranare? Ce se întâmplă cu structura canalului după terminarea translocării? La ce oră și în ce mod se leagă proteinele care sunt aproape de translocon?
Chiar mai puțin studiat este chestiunea modului în care ESR efectuează plierea proteinelor și, de asemenea, recunoaște și elimină proteinele cu o structură neregulată. Aproape complet neexplorat cel mai fundamental aspect al procesului, cum organele "simt" proteinele corect și necorespunzător asamblate. Trebuie să învățăm multe despre modul în care chaperonii interacționează cu proteinele. Este necesar să se determine cât de bine interacționează numeroasele sisteme de chaperone ESR și dacă acestea au funcții diferite sau suprapuse. De asemenea, rămâne neclar modul în care celula decide să degradeze o proteină care are o structură neregulată.
Existența unui mecanism care limitează durata interacțiunii sale cu chaperonele pare a fi atractivă. Cu toate acestea, nu există ipoteze cu privire la modul în care poate funcționa. În cele din urmă, nu se știe cum proteina selectată pentru degradare este trimisă înapoi în canal și în citozol. Același lucru se aplică mecanismului prin care un canal se poate deschide din interior.
În cele din urmă, mecanismele sunt necunoscute. controlând dinamica RPE ca un întreg. Cum își menține organele forma sa caracteristică? Cum sunt suportate subcomponentele? Cum se leagă EPR de citoschelet și cum se mișcă în celulă? Ce determină dimensiunea EPR și cum se extinde? Existența unui răspuns al proteinelor nestructurate indică relația dintre EPR și nucleu. Este posibil ca prezența unei astfel de relații să contribuie la răspunsul la unele dintre caracteristicile enumerate în EPR. Prezența contactelor dintre EPR și alte compartimente de celule ne permite să presupunem că este posibil un schimb între ei, cu toate acestea, în ce mod concret acest lucru poate să apară, rămâne necunoscut.
Celula conține multe organeluri diferite. înconjurat de membrane, dintre care unele importă proteine direct din citozol. Mitochondria, cloroplastul și peroxizomii importă proteinele necesare. Reticulului endoplasmatic (ER) ca proteinele sunt importate din citosol, dar cele mai multe dintre aceste proteine sunt transportate mai departe, sau secretate sau organite funcții ah și membranele care nu pot importa ele însele proteine. Acestea includ membrana plasmatică și organele ale căii secretorii sau endocitozelor.
Proteine importate în organele. sunt identificați printr-o secvență semnal care este un lanț scurt de aminoacizi, localizat de obicei la capătul N-terminal al lanțului. Secvențele corespunzătoare diferitelor organele diferă în funcție de lungime și de compoziție. Secvențele EPR conțin aproximativ douăzeci de aminoacizi și sunt caracterizate printr-o regiune extinsă constând din reziduuri hidrofobe. Secvențele de semnale ale mitocondriilor posedă dimensiuni similare. Cu toate acestea, ele conțin grupuri alternante de aminoacizi hidrofobi și încărcați. Prin urmare, atunci când secvența de semnal are forma unei spirale, o parte devine hidrofobă, iar cealaltă parte devine hidrofobă, iar cealaltă parte devine hidrofobă.
Secvența de semnal peroxizomic constă de obicei numai din trei resturi de aminoacizi. În toate cazurile, proteinele sunt identificate și poziționate nu mai corespund compoziției secvențelor semnal, ci pe baza proprietăților lor fizice.
Fiecare tip de secvență semnal se leagă de un receptor specific. care direcționează proteina către o anumită organelle. Când proteina ajunge la organelle, este translocată în interiorul acesteia prin canalul membranei. Din momentul recunoașterii secvenței semnalului, în timpul sintezei proteinei sau după finalizarea acesteia, depinde tipul de translocație. Translocarea cotranslațională are loc în cazurile în care secvența de semnal este recunoscută în timpul sintezei proteinelor. În acest caz, ribozomul pe care se sintetizează proteina se leagă de membrană și proteina rezultată este transferată pe canalul de translocație. Translocația post-translațională apare atunci când secvența de semnal este recunoscută după terminarea sintezei proteinelor.
Cele mai multe proteine intră în EPR prin translocare prin cotranslație. Imediat după ieșirea secvenței de semnal de la ribozom, o particulă care recunoaște semnalul (SRP) este conectată la ea. Ribozomul și proteina în creștere sunt poziționate pe membrana EPR datorită interacțiunii dintre SRP și receptorul său. Apoi, ribozomul, împreună cu lanțul de creștere, ocupă canalul prin care proteina trece prin membrană. Miezul canalului este format din complexul Sec61, în jurul - un grup mare de proteine implicate în translocare. Toate acestea împreună se numește translocon. Atunci când interacționează cu secvența de semnal, canalul se deschide, ceea ce permite lanțului să o introducă într-un mod care exclude transportul altor molecule prin membrana EPR. Traducerea continuă atât timp cât ribozomul rămâne conectat la canal, iar proteina este transportată prin acesta în lumen.
Integrarea proteinelor în membrana EPR începe în momentul în care domeniul transmembranar începe să fie tradus și intră pe canal. Deoarece domeniile transmembranare sunt hidrofobe, ele sunt recunoscute de canal și trec prin pereții săi în bilayer lipidic al membranei. După recunoașterea domeniului transmembranar, transportul proteinei rezultate prin membrană încetează. Totuși, traducerea continuă, ceea ce duce la ieșirea altor secțiuni ale lanțului polipeptidic în citozol. Pentru a integra complet proteinele membranare cu mai multe domenii transmembranare, este probabil necesară deschiderea și închiderea mai multor canale.
Procesul de integrare a proteinelor membranare este complicat de necesitatea orientării lor specifice în membrană. Evident, depinde de proprietățile domeniilor transmembranare ale proteinelor. Cu toate acestea, nu este clar modul în care domeniile ar trebui să interacționeze cu canalul, lipidele membranare sau unul cu celălalt pentru a determina orientarea proteinelor.
Când sunt translocați în ESR, multe proteine suferă modificări covalente. În mod obișnuit, secvența semnal este îndepărtată de peptidază la scurt timp după ce proteina intră în canal. Secțiunile rămase ale moleculei proteinei translocate sunt adesea modificate după ce au trecut în lumen. Pentru a proteinei poate fi adăugat oligosaharidtransferazoy resturile de zahăr sau de proteindisulfidizomerazy acțiune (PDI) pot forma legături disulfidice în moleculă. Unele proteine translocarea aproape complet scindat la porțiunea C-terminală și alăturarea glikozilfos-fatidilinozitolu (GPI), un fosfolipid, care le conectează cu membrana.
După intrarea în lumen, proteinele încep să dobândească o structură nativă. Acest lucru este asigurat de un număr mare de chaperoni diferiți. BiP și Grp94 interacționează direct cu proteine nestructurate. Calnexinul și calreticulina se leagă de resturile de zahăr, care se adaugă la proteine în timpul translocării. Ei participă, de asemenea, la procesul de adăugare a unui rest de glucoză în lanțul polipeptidic. Prezența reziduului dă indicații despre cât de bine structura nativă a proteinei are un PDI este implicat în rearanjarea legăturilor disulfurice, care însoțește proteina de structurare. După proteine de achiziție structura nativă corespunzătoare care nu mai reacționează cu chaperone și sunt capabili de a ieși din EPR în aparatul Golgi Dacă formarea mai multor încercări structura nativă corespunzătoare a proteinei nu au avut succes sau proteină nu poate forma un complex cu alte proteine, acesta este returnat la canalul și înapoi la citosol datorită translocării retrograde. Când intră în citozol, acesta suferă degradare în proteozomi.
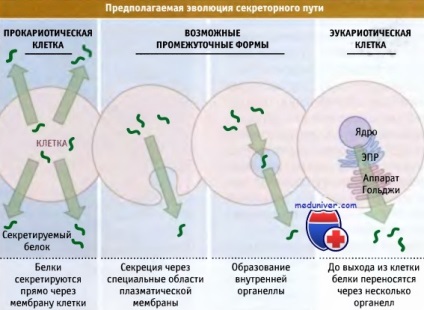
care are funcția de secreție de proteine.
În celulele eucariote, proteinele nu sunt secretate direct prin membrana plasmatică,
dar sunt transportate în lumenul EPR, care în compoziție seamănă cu mediul extern al celulei.
Acumularea în EPR a unor cantități mari de proteine care nu au o structură nativă determină răspunsul proteinelor nestructurate. Acesta este un lanț de semnale din EPR către nucleu, care oferă o sinteză suplimentară de chaperone. Semnalul este mediat de proteine transmembranare, componente EPR rezidente care recunosc prezența proteinelor nestructurate care nu sunt asociate cu BiP. În același timp, evenimentele sunt declanșate, ca urmare a schimbării expresiei genelor, iar ESR este capabilă să depășească consecințele excesului de proteine nestructurate. În cazul eucariotelor superioare, în starea de stres continuă, aceleași procese determină moartea celulelor.
Importul de proteine în mitocondrii și cloroplaste are loc după terminarea traducerii. Ambele organele sunt caracterizate de existența a două membrane. Proteinele pot fi localizate într-una din membrane, în spațiul inter-membranar sau în interiorul organelor. Fiecare membrană are propriul translocon. În mitocondriile, acestea sunt denumite TOM pentru membrana exterioară și TIM pentru membrana interioară, respectiv pentru cloroplastele TOC și TIC, respectiv. Secvențele de semnal sunt recunoscute de translonul membranei exterioare. Translocoanele membranelor interioare și exterioare sunt interconectate, astfel încât proteinele importate sunt transferate direct între ele. Proteinele mitocondriale pot fi transportate prin ambele membrane și apoi, atunci când recunoaște o secvență de semnal separată, să fie direcționate din nou spre membrana interioară.
În translocarea proteinelor de cloroplaste, o secvență de semnal special participă, de asemenea, prin membrana organelor interne, numită thylakoid.
Belov translocare mitocondrială se produce din cauza un gradient electrochimic prin membrana internă și forțele de interacțiune între proteine și chaperones importate în matricea mitocondrială. Datorită ceea ce se întâmplă în translocație cloroplastidiană rămâne neclar. De asemenea, nu știu cum este integrarea proteinelor in membranele acestor organite.
Transportul proteinelor în peroxisomi are loc după translație, dar diferă de translocarea lor în alte organele. Când este importat în peroxizomi, proteina trece printr-o membrană și procesul începe după ce a dobândit o structură nativă în citozol. Secvența semnal pentru peroxisomi este recunoscută în citozol cu participarea proteinelor care rămân legate la substrat în momentul translocării sale. Suporții de proteine disociază numai după ce au apărut în interiorul organelle și se reîntorc la citozol pentru utilizare ulterioară. Originea proteinelor membranare de către peroxizomi rămâne necunoscută.
Împreună cu importul. maturarea și distribuția proteinelor, EPR îndeplinește mai multe funcții în celulă. Funcțiile sale sunt reflectate în structură. Translocarea și maturarea proteinelor apar în EPR granular, acoperit cu ribozomi. Smooth EPR diferă de granular. De obicei, este un tub, organizat într-o rețea dinamică, ramificat pe toată suprafața citosolului. EPR neted este adesea asociat cu elemente citoschelet și contactează alte membrane celulare. Printre funcțiile sale este sinteza lipidelor pentru toate membranele celulare. Lipidele trebuie transportate cumva din EPR în alte membrane, dar nu se știe cum se întâmplă acest lucru. Este posibil ca acest lucru să se întâmple la punctele de contact ale EPR netede cu alte membrane. EPR servește și ca rezervor de calciu intracelular. Calciul iese ca răspuns la semnalul primit de celulă și, după îndeplinirea funcțiilor sale, este pompat înapoi în organelle.
In celulele specializate din buna EPR asemenea poate fi sintetizat hormoni liposolubile sau neutralizeaza celule produse chimice potențial periculoase. In celulele specializate pentru a îndeplini orice funcție exercitată datorită ESR, de exemplu, secreta mai multe proteine, hormoni steroizi sau generatoare, pot fi formate în continuare EPR neted sau granulară și dețin în aceasta o mare parte din citosol. In aceste celule extrem de specializate ca muschii scheletici, ESR este, de asemenea, extrem de extrem de specializate în compoziția și structura lor. reticulul sarcoplasmic, care este un EPR neted specializat înfășurat în jurul sarcomeres musculaturii scheletice și adaptat pentru a livra ioni de calciu, stimulând contracția musculară.
Trimiteți-le prietenilor: