Suplimente nutritive
Cerințe pentru mediu
- fi hrănitoare; conține în formă ușor digerabilă toate substanțele necesare pentru satisfacerea nevoilor alimentare și energetice. Când se cultivă un număr de microorganisme, factorii de creștere sunt introduși în mediu - vitaminele, niște aminoacizi pe care celulele nu le pot sintetiza.
- au concentrația optimă de ioni de hidrogen - pH, deoarece Numai cu reacția optimă a mediului care afectează permeabilitatea cochiliei, microorganismele pot absorbi substanțele nutritive.
Pentru majoritatea bacteriilor patogene, un mediu ușor alcalin este optim (pH 7,2-7,4). Excepțiile sunt cholerae Vibrio - este optimă în zona alcalină (pH 8,5-9,0) și agentul cauzator al tuberculozei are nevoie de ușor acid (pH 6,2-6,8).
Astfel că, în timpul creșterii microorganismelor, produsele acide sau alcaline ale activității lor vitale nu modifică pH-ul, mediul trebuie să aibă tamponare. și anume conțin substanțe care neutralizează produsele metabolismului.
- să fie izotonică pentru o celulă microbiană; și anume Presiunea osmotică în mediu trebuie să fie aceeași ca în interiorul celulei. Pentru cele mai multe microorganisme, mediul optim corespunde unei soluții de 0,5% de clorură de sodiu.
- fi sterilă, pentru că microbii străini interferă cu creșterea microbului studiat, determină proprietățile și modifică proprietățile mediului.
- Mediile dense trebuie să fie umede și să aibă o consistență optimă pentru microorganisme.
- au un anumit potențial de reducere a oxidării, adică raportul dintre substanțele care dau și primesc electroni, exprimat prin indicele RH2. De exemplu, anaerobii se reproduc la RH2. nu mai mare de 5 și aerobi - cu RH2 nu mai mic de 10.
- să fie cât mai uniform posibil, adică conține o cantitate constantă de ingrediente individuale.
Este de dorit ca mediile să fie transparente - este mai convenabil să se monitorizeze creșterea culturilor, este mai ușor să se observe contaminarea mediului cu microorganisme străine.

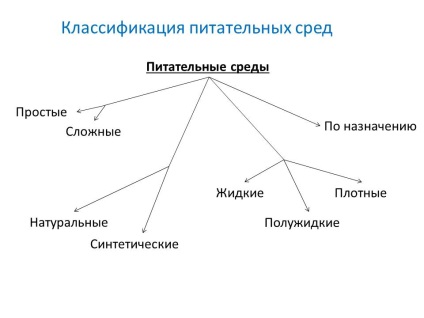
- Prin componentele sursă:
- mediu natural - este preparat din origine vegetală și animală (carne, făină de oase și pește, drojdie furajeră, cheaguri de sânge, etc.).
- medii sintetice - sunt preparate din anumiți compuși organici și anorganici puri din punct de vedere chimic, luați la concentrații exact specificate și dizolvate în apă dublu distilată.
- Prin consistență (grad de densitate):
- lichid
- semi
- gros
Mediile dense și semi-lichide sunt preparate din lichid, la care se adaugă agar-agar sau gelatină. Mai mult, deoarece media dens este utilizat în ser gâtuit ouă de sânge îngustată, cartofi, mediu selikagelem.Nekotorye cu microorganisme utilizează gelatina ca un nutrient - dacă creșterea lor este lichefiat pentru transport.
- Prin compoziție:
- simplă: bulion peptonă de carne (MBP), agar de peptonă din carne (MPA). gelatină nutritivă,
- complex - pregătiți pentru a adăuga la medii simple sânge, ser, carbohidrați și alte substanțe.
- Prin programare:
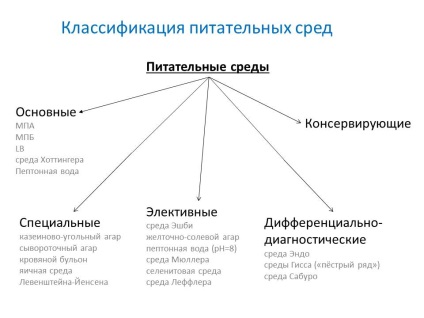
- de bază - servesc pentru cultivarea majorității microbilor patogeni. MPB, MPA, bulion și agar Hottingera, apă peptonă.
- Special - servesc la izolarea și creșterea microorganismelor care nu cresc pe suporturi simple.
- electivă (selectivă) - servesc la izolarea unui tip specific de microbi, a căror creștere favorizează, întârziind sau suprimând creșterea microorganismelor concomitente. Mediile devin elective când se adaugă anumite antibiotice, săruri, modificări ale pH-ului. Lichidele elective media se numesc mijloace de acumulare.
- diagnostic diferențial - permite o diferențiere între un tip de microbian și altul prin activitate enzimatică.
- Conservant - conceput pentru însămânțarea primară și transportul materialului de testare.
- Concentrat de peptonă din carne (MPB) - un mediu lichid
- Agar de peptonă din carne (MPA) este un mediu dens
special
Metodele speciale sunt caracterizate prin adăugarea unei componente specifice sau înlocuirea substratului.
- cazer-carbon agar
- ser agar
- sânge de sânge
- mediul de ou Levenstein-Jensen
electiv
Metodele opționale sunt caracterizate prin creșterea doar a microorganismelor de interes.
- Mediul Ashby - pentru fixatorii de azot
- galben-sare-sare agar (HSA) - pentru stafilococul aureus
- apă peptonă (1%, pH = 8) - pentru holera vibrio
- Mediul lui Muller pentru salmonella
- mediu selenit - pentru salmonella
- Leffler mediu - eficace pentru corneebacteria difterie
diagnosticul diferențial
Permite identificarea tipurilor, speciilor și grupurilor de bacterii individuale.
- mediul din Giss ("seria ciudată")
- Endomo - definiția enterobacteriilor virulente
- Miercuri Saburo - cu adăugarea unui antibiotic
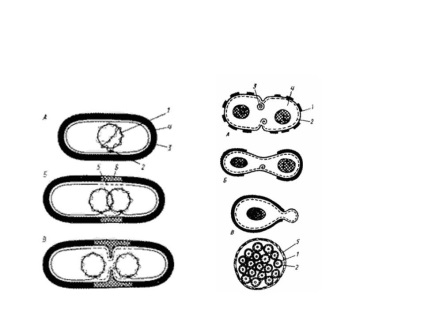

Culturi sincrone
Culturile sincrone sunt culturi sau populații bacteriene în care toate celulele sunt în aceeași etapă a ciclului celular. În culturile naturale - periodice și care curg - acest fenomen nu este respectat. Chiar și în faza exponențială a creșterii, culturile conțin celule nediferențiate care se află în diferite etape ale divizării. Divizarea celulară sincronă este indusă artificial, afectând cultura prin diferiți factori, de exemplu temperatura redusă sau ridicată. Se crede că temperaturile adverse afectează dezvoltarea celulelor divizibile mai sensibile la efectele diferiților factori. Ca urmare, dezvoltarea încetinește. În acest timp alte celule de cultură sunt pregătite pentru divizare. Următorul efect al temperaturii optime determină treptat divizarea celulară sincronă. Pentru a obține culturi sincrone, se folosește metoda de foamete forțată. Celulele sunt plasate pe un mediu defect, cultivate, apoi transferate într-unul complet. În bacteriile fotosintetice, culturile sincrone sunt obținute prin schimbarea regimurilor de cultivare a luminii și întunericului. Sunt utilizate și metode mecanice: cultura care trece prin filtre speciale (selecția de celule de aceeași mărime) și centrifugare (celulele de la începutul ciclului de fisiune sunt mai mici și se regăresc mai încet).
Culorile sincrone sunt utilizate pentru a studia sinteza componentelor celulare individuale în procesul de diviziune celulară.
Culturile continue
În anii 50 ai secolului XX sa dezvoltat o metodă de cultivare continuă a microorganismelor (metoda culturilor). Esența metodei este că cultivatorul, în cazul în care bacteria este cultivată, primește în mod constant un mediu nutritiv proaspăt și, în același timp, lichidul de cultură este retras la aceeași rată. Ca rezultat, condițiile microbiene sunt create în mod invariabil în ceea ce privește disponibilitatea substanțelor nutritive și practic nu există produse de schimb. Prin reglarea vitezei medii de curgere, este posibil să se controleze dezvoltarea populației bacteriene, de exemplu, pentru a menține cultura în faza de creștere logaritmică pentru o perioadă lungă de timp.
Cultivarea continuă se realizează în dispozitive speciale - chemostați și turbidostați. În chimiostați, creșterea culturii este controlată de concentrația substratului. Prin menținerea unei concentrații constante a unuia dintre substraturile necesare (sursa de azot sau carbon) prin controlul debitului mediului, este posibilă stabilizarea vitezei de creștere a culturii și a densității populației. La debitele mari ale mediului, creșterea culturii este mai intensă și se apropie de un maxim; la dimensiuni mai mici - mai lent datorită unei cantități reduse de substrat. Cu toate acestea, o creștere a debitului pentru a elimina restricția de creștere a culturii substratului duce la eluția culturii, o scădere a densității populației.
Spre deosebire de chemostati, principiul turbidostatului se bazeaza pe reglarea vitezei de curgere a mediului prin densitatea populatiei. În turbidostat, densitatea populației este controlată de o fotocelula conectată la un releu care reglează alimentarea mediului. De îndată ce densitatea populației atinge un nivel predeterminat, releul este declanșat și un mediu proaspăt începe să intre în cultivator. Ca urmare, concentrația de celule scade la un anumit nivel, după care alimentarea mediului este oprită automat. În turbidostat, rata maximă de creștere a culturii este atinsă cu o densitate mai mare a populației și o mai mare precizie în reglarea intrării mediului.
Cultivarea curgerii microorganismelor este utilizată în studiul fiziologiei microorganismelor, tk. le permite să fie cultivate în condiții controlate. În plus, această metodă a găsit o aplicare largă în industria microbiologică, tk. oferă ocazia de a controla procesele biosintetice ale microorganismelor.

Izolarea culturilor pure de microorganisme
Cultura pură se referă la o cultură care conține microorganisme din aceeași specie. Izolarea culturi pure de bacterii - o etapă necesară de cercetare bacteriologice în diagnosticul de laborator al bolilor infecțioase, în studierea diverse contaminarea microbiană a mediului și, în general, la orice lucrare cu microorganisme. Materialul de testare (puroi, spută, fecale, sânge și alte materiale de la pacienți, carne de apă, sol, aer, alimente, animale și umane, purtători) conține de obicei asociații microbiene.
Izolarea unei culturi pure face posibilă studierea morfologiei, culturii. biochimice, antigenice și alte semne, ale căror agregate determină speciile și tipul agentului cauzal, adică identificarea sa este făcută.
Pentru a izola culturile pure de microorganisme, se folosesc metode care pot fi împărțite în mai multe grupuri.
- Metoda lui Pasteur este diluarea secvențială a materialului de testare într-un mediu nutritiv lichid până la concentrația unei celule din volum (are semnificație istorică).
- Metoda lui Koch ( „placă de cabluri“) - o diluție în serie a materialului de testat în agar topit (temperatura 48-50 ° C), urmată de umplerea într-un vas Petri unde agar se solidifică. Semănarea se face, de regulă, din ultimele trei sau patru ultime diluții, unde există mai puține bacterii și, în viitor, când cresc pe feluri de mâncare Petri, apar colonii izolate, formate dintr-o celulă maternă singură părinte. Din colonii izolate în adâncul agarului, o cultură pură de bacterii se obține prin replantare în medii proaspete.
- Metoda Shukevich este utilizată pentru a obține o cultură pură a proteinei și a altor microorganisme care posedă o creștere "târâtoare". Semănarea materialului de testare se efectuează în apa de condensare la baza agarului tivit. Mijloacele mobile (proteas) sunt capabile să urce în sus pe agarul de coacere. Totuși, formele continuă să crească în partea de jos a locului de însămânțare. Prin transplantarea marginilor superioare ale culturii, se poate obține o cultură pură.
- Metoda lui Drigalsky este utilizată pe scară largă în practica bacteriologică, în timp ce materialul de testare este diluat într-o eprubetă cu soluție salină sterilă sau bulion. O singură picătură de material este introdusă în prima farfurie și o spatulă de sticlă sterilă se întinde pe suprafața mediului. Apoi, cu aceeași spatula (fără a le arde în flacăra arzătorului), faceți aceeași însămânțare în a doua și a treia ceașcă. Cu fiecare însămânțare a bacteriilor pe spatulă, rămân mai puțin și mai puțin și, când sunt semănate în a treia ceașcă, bacteriile vor fi distribuite separat pe suprafața mediului nutritiv. După 1-7 zile într-un incubator păstrarea cupe (în funcție de rata de creștere a microorganismului) în a treia cupa dă fiecare clonă de celule bacterie izolată formatoare de colonii care subcultivat pe agar înclinat pentru a se acumula o cultură pură.
- Metoda lui Weinberg. Dificultăți speciale apar în izolarea culturilor pure de anaerobe obligatorii. Dacă contactul cu oxigenul molecular nu provoacă imediat moartea celulelor, atunci cultura este produsă prin metoda Drigalsky. dar după aceea, cupele sunt plasate imediat în anaerostat. Cu toate acestea, metoda de reproducere este adesea folosită. Esența sa constă în faptul că diluțiile materialului investigat sunt efectuate în mediu nutritiv agar topit și răcit la 45-50 ° C. S-au realizat 6-10 diluții succesive, apoi mediul din tuburile de testare este răcit rapid și suprafața este acoperită cu un strat de amestec de parafină și ulei de petrol pentru a împiedica pătrunderea aerului în mediul nutritiv. Uneori, mediul nutritiv după însămânțare și amestecare este transferat în tuburi sterile Burri sau pipetă capilară Pasteur, ale căror capete sunt etanșeizate. Cu o diluție reușită în eprubete, tuburi Burri. Piperele Pasteur cresc colonii izolate de anaerobe. Pentru a face coloniile izolate bine vizibile, utilizați medii nutritive clarificate. Pentru a extrage tub colonii izolate anaerobi încălzit ușor se rotește în flacără, agar. adiacente pereților și conținutul tubului se topește ca o coloană de agar alunecă într-un vas Petri sterilă. Plăcuța de agar este tăiată cu pensete sterile, iar coloniile sunt îndepărtate printr-o buclă. colonii extrași au fost plasate într-un mediu lichid, favorabil dezvoltării microorganismelor alocate (de exemplu, mediu Kitty Tarotstsi). Mediul agarizat din tubul Burri este suflat, trecând gazul printr-o plută vată.
- Metoda Hangate - când doresc să obțină colonii izolate de bacterii cu o sensibilitate deosebit de ridicată la oxigen (aerobi austere) utilizează metoda de rotire a tuburilor Hangate. Pentru a face acest lucru, mediul agar topit este inoculat cu bacterii la un curent constant printr-un tub de testare a unui gaz inert eliberat de o impuritate de oxigen. Apoi, tubul este închis cu un dop din cauciuc și plasat orizontal în clemă, rotind tubul, mediul este distribuit uniform pe pereții tubului și solidificat cu un strat subțire. Utilizarea unui strat subțire într-un tub de testare umplut cu un amestec de gaze face posibilă obținerea unor colonii izolate care sunt vizibile cu ochiul liber.
- Izolarea celulelor individuale cu un micromanipulator. Micromanipulatorul este un dispozitiv care permite o celulă din suspensie să fie extrasă cu o micropipetă specială sau micro-bucla. Această operație este monitorizată sub microscop. O cameră umedă este plasată pe scena microscopului, în care este plasat preparatul "picătură suspendată". În suporturile trepiedelor de operare, sunt fixate micropipete (microblocuri), mișcarea acestora din câmpul de vedere al microscopului se efectuează cu o precizie micronă datorită unui sistem de șuruburi și pârghii. Cercetătorul, analizând microscopul, extrage celule individuale cu micropipete și le transferă în tuburi de testare cu un mediu lichid steril pentru a obține o clonă de celule.
Articole similare
Trimiteți-le prietenilor: