Reacțiile în soluțiile de electroliți apar între ioni, la care substanțele dizolvate disociază. În același timp, stările de oxidare ale elementelor nu se schimbă.
Nu toate reacțiile de schimb ionic sunt ireversibile. Reacțiile de schimb ionic merg până la sfârșit dacă reacția conduce la formarea:
-un precipitat compus insolubil;
-electrolitic slab (apă, bază slabă sau acid slab).
-- Ecuațiile reacțiilor de acest tip sunt mai corect scrise nu în formă moleculară, ci în formă moleculară ionică. În aceste ecuații se indică ionii în care moleculele de electroliți puternici se descompun. Substanțele slab solubile eliberate din soluție sub formă de precipitat, compuși gazoși și electroliți slabi în aceste ecuații sunt scrise în formă moleculară. În plus, există o formă ionică scurtă de înregistrare a ecuației de reacție, care reflectă natura reacției care are loc în soluția de electrolit.
Exemple de reacții care devin ireversibile
1. Formarea sedimentului
- ecuația reacției moleculare,
Ba2 + + 2C1 - + 2Na + + SO
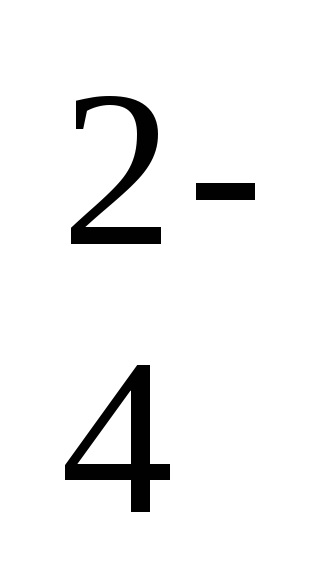
- ion-ecuația moleculară a reacției,
Ba 2+ + SO
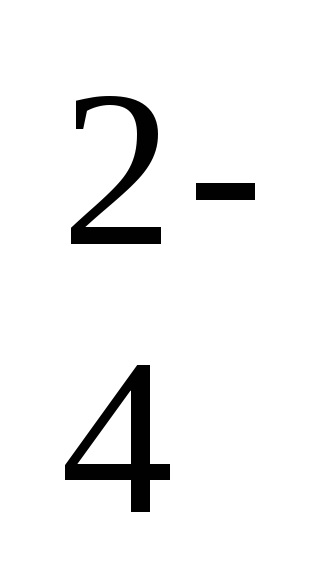
2. Formarea unei substanțe gazoase
- ecuația reacției moleculare,
2Na + + S2 + + 2H + + 2CI - = H2S ↑ + 2Na + + 2Cl -
-ion-ecuația moleculară a reacției,
2H + + S2 = H2S ↑ este o formă scurtă a ecuației de reacție.
3. Formarea unui electrolit slab
a) Apă: 2NaOH + H2SO4 = H20 + Na2S04 - ecuația moleculară a reacției,
2Na + + 2OH - + 2H + + SO
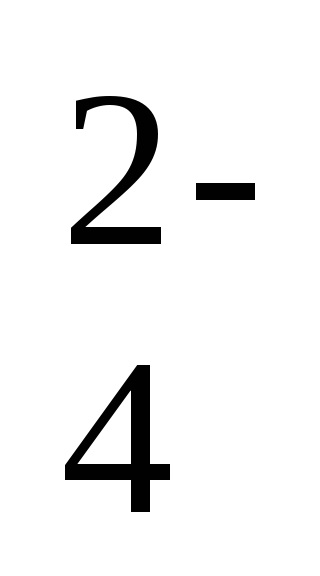
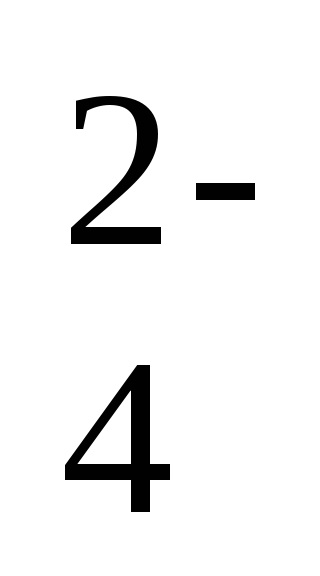
-ion-ecuația moleculară a reacției,
2OH - + 2H + = 2H2O - o formă scurtă a ecuației de reacție.
Reacția de neutralizare a unui acid puternic cu o bază tare este redusă la interacțiunea ionilor de hidrogen cu ionii de hidroxid.
b) Acid slab:
- ecuația reacției moleculare,
2Na + + 2NO2 - + 2H + + SO
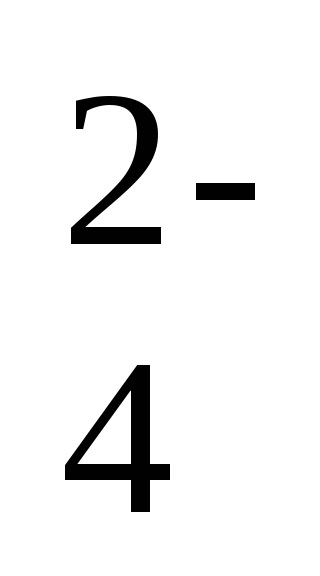
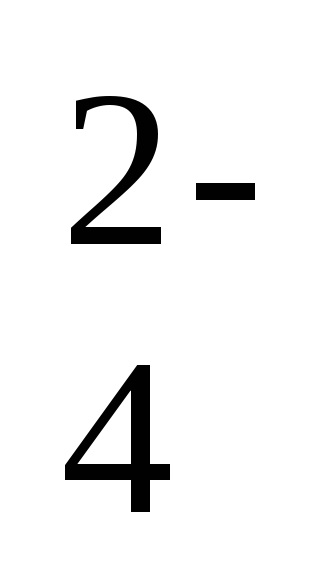
-ion-ecuația moleculară a reacției,
2H + + 2NO2 - = 2HNO2 - o formă scurtă a ecuației de reacție.
Acizii puternici elimină acizii slabi din sărurile lor.
c) baza slabă:
NH4CI + NaOH = NH4OH + NaCI
- ecuația reacției moleculare,
NH4 + + Cl - + Na + + OH - = NH4OH + Na + + Cl -
-ion-ecuația moleculară a reacției,
NH4 + + OH - = NH4OH - o formă scurtă a ecuației de reacție.
Bazele puternice înlocuiesc bazele slabe din sărurile lor.
Hidroxizi amfoterici
Hidroxizii amfoterici sunt compuși insolubili în apă de tip Me (OH) n. care interacționează atât cu soluții acide, cât și cu soluții de alcalii. Reacționând cu soluții acide, ele prezintă proprietățile de bază:
Reacționând cu soluții de alcalii, ele prezintă proprietăți acide, formând astfel compuși hidroxocomplexi:
Produs de solubilitate
Absolut nici o probleme insolubile. Cele mai multe dintre solidele au solubilitate limitată. Soluțiile saturate de electroliți cu moderație substanțe solubile într-o stare de echilibru dinamic și precipitat sunt soluții de electrolit saturate. De exemplu, într-o soluție de sulfat de bariu saturată în contact cu cristalele de substanță, un echilibru dinamic: BaSO4 (r) ⇄ Ba 2+ (p) + SO
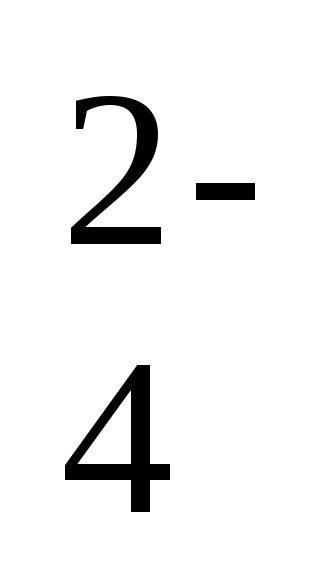
Pentru acest proces de echilibru se poate scrie expresia pentru constanta de echilibru, tinand cont de faptul ca concentratia fazei solide nu este inclusa in expresia pentru constanta de echilibru: Kp = [Ba 2+] [SO
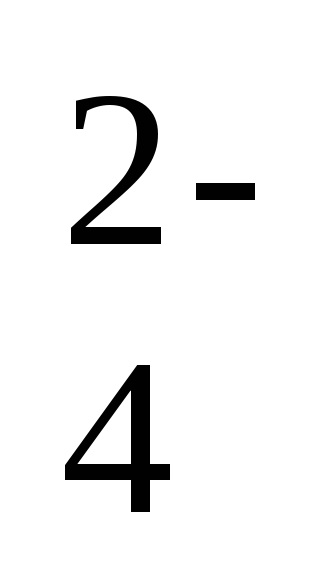
Această cantitate se numește produsul de solubilitate al unei substanțe puțin solubile (OL). Astfel, într-o soluție saturată de compus slab solubil, produsul concentrațiilor ionilor săi în gradul coeficienților stoichiometrici este egal cu valoarea produsului de solubilitate. În exemplul considerat, PR (BaS04) = [Ba2 +] [SO
Articole similare
Trimiteți-le prietenilor: