Mulți entuziaști de mașini se întreabă ce fel de acid este încorporat în bateria mașinii. Din ignoranță, sunt exprimate diferite ipoteze incorecte. Cineva spune că există acid clorhidric. Unii cred că există apă. Este timpul să clarificăm această problemă. În bateria plumb-acid a mașinii este umplut cu acid sulfuric. Dacă se exprimă cu exactitate, se toarnă o soluție de acid sulfuric în apă distilată. Această soluție a fost numită electrolit.
Aplicarea acidului sulfuric și gradul acestuia
În general, alcalinele pot fi utilizate ca electrolit la unele tipuri de baterii auto. De exemplu, nichel-cadmiu sau nichel-fier tip AKB. Există, de asemenea, un grup de baterii gel AGM și GEL, unde electrolitul este într-o stare legată. Dar aceasta este aceeași soluție de acid sulfuric. Pur și simplu, fie este transferat în starea gelului cu ajutorul aditivilor (GEL), fie este impregnat cu fibră de sticlă (AGM). Cele mai frecvente astăzi sunt bateriile plumb-acid cu electrolit lichid. Prin urmare, va fi doar o soluție apoasă de acid sulfuric, destinată turnării în baterie.
Acidul sulfuric este utilizat în diverse ramuri ale economiei naționale. De exemplu, cu ajutorul său, suprafața metalică este curățată înainte de acoperire, este utilizată pentru prepararea diferitelor coloranți sintetici. În plus, acidul sulfuric este solicitat în producția de îngrășăminte, explozivi, industria farmacologică, rafinarea petrolului.
Acidul sulfuric a găsit o aplicare largă în producția de baterii cu plumb-acid pentru automobile. Concentrația de acid în electrolit este de 30-35 procente (în greutate). Restul este apă distilată. Folosiți apă de la robinet, nu este posibilă, deoarece conține săruri de metale diferite. Pătrunderea lor în bateria mașinii va scurta în mod semnificativ durata sa de viață.
În sfera domestică, concentrația H2SO4 este de 30% suficientă, dar acidul sulfuric cu o concentrație mai mare este adesea folosit în sfera de producție. Acidul sulfuric concentrat se obține în două etape. În prima etapă, concentrația este adusă la 70% și apoi crește la 98%. Acidul sulfuric din această concentrație este cel mai potrivit pentru depozitarea ulterioară. Este posibil să se obțină o concentrație de 99%, dar în viitor, din cauza pierderii de SO3, se reduce la 98,3%.
Există varietăți de bază ale acidului sulfuric, care sunt enumerate mai jos:
Procesele care au loc în baterie cu participarea electrolitului
Activitatea bateriei cu plumb-acid este bazată pe procesele electrochimice care au loc cu participarea electrolitului. Bateria autovehiculului este formată din plăci pozitive și negative, scufundate într-o soluție apoasă de acid sulfuric. Plăcile pozitive și negative au gratare de plumb cu diverse aditivi, în funcție de tipul bateriei.
Dioxidul de plumb roșu-maroniu (PbO2) este depus pe grilajele electrodului pozitiv. Pe electrozii negativi - pulbere cenușie de plumb (Pb). Caracteristicile electrice ale bateriei depind direct de densitatea electrolitului. Pentru a înțelege scopul electrolitului, trebuie să luați în considerare procesele principale care au loc în bateria mașinii.
Când bateria este descărcată pe electrod pozitiv (anod), se produce următoarea reacție:
Pe electrodul negativ (catod) acest proces are loc:
Când bateria este încărcată, aceste reacții se desfășoară în direcția opusă.
Electrolitul într-o baterie de plumb-acid de mașină are o densitate diferită, în funcție de gradul de încărcare al bateriei. După cum sa menționat mai sus, nota concentrată baterie acidă are o densitate de 1,835 g / cm3 la o densitate a bateriei electrolit încărcată variază de 1,127─1,300 g / cm 3. Când descărcarea bateriei autovehiculului în reacția electrochimică a electrolitului acid sulfuric uzat și stropii de densitate . În timp ce bateria trece prin curentul de descărcare, acidul de lângă electrozi este consumat ca urmare a reacției de mai sus. Există difuzia de H2SO4 din volum la electrozi. Astfel, tensiunea la bornele bateriei este menținută.
La începutul descărcării, procesul de difuzie a acidului în electrozi. Acest lucru se explică prin faptul că, în masa activă a electrozilor, porii nu sunt încă înfundați cu sulfat. Deoarece formează un strat de sulfat și înfundă porii, procesul de difuzie încetinește. În teorie, procesul de descărcare poate continua până când electrolitul se transformă în apă. Dar, în practică, evacuarea se face până la densitatea nu se încadrează la o valoare de 1,15 g / cm 3. La momentul de cădere densitate până la 1,15 g / cm3 eliberat la fel de mult sulfat de plumb, care a fost suficient pentru a sigila masele active ale plăcilor. Din densitatea electrolitului, se poate evalua gradul de încărcare al bateriei. Pentru a face acest lucru, puteți utiliza tabelul de mai jos.
Densitatea electrolitului, g / cm. cu. (+15 grade Celsius)
Tensiune, V (fără sarcină)
Tensiune, V (cu sarcină 100 A)
Nivelul de încărcare a acumulatorului,%
O celulă complet încărcată a bateriei produce o tensiune de 2,5-2,7 volți fără sarcină la ieșiri. Atunci când sarcina este conectată, tensiunea se scade la 2,1 volți în câteva minute. În acest timp, un strat de PbSO4 se formează pe suprafața electrozilor negativi. Adică, tensiunea unui element pe bateria conectată la mașină este de aproximativ 2,15 volți.
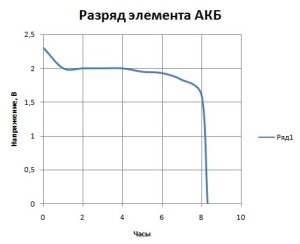
Dacă descărcați bateria mașinii cu un curent mic (10% din capacitatea nominală), după o oră de descărcare, tensiunea celulei scade la 2 volți. Aceasta se datorează faptului că în acest moment se formează rapid o cantitate mare de PbSO4. care înfundă porii din masa activă. Ca urmare, rezistența internă a bateriilor crește, iar concentrația electrolitului scade. După un timp, procesul de descărcare devine drept (vezi graficul).

Graficul de descărcare a bateriilor
Această linie dreaptă corespunde echilibrului densității electrolitului în apropierea electrozilor și restului volumului. Treptat, acidul provine de la volum la electrozi și reacționează cu eliberarea sulfatului de plumb. Densitatea electrolitului scade treptat, iar tensiunea scade mai încet decât în stadiul inițial. Și în stadiul final, când masa activă este blocată de sulfatul de plumb format, reacția încetinește și tensiunea scade rapid.
Înapoi la cuprins
Monitorizarea stării electrolitice a bateriei?
De la proprietarul mașinii este necesară verificarea periodică a nivelului de electroliți din baterie și densitatea acesteia. Pentru a controla nivelul electroliților, puteți utiliza un tub de sticlă. Dacă nu este la îndemână, atunci puteți folosi o carcasă transparentă din plastic dintr-un stilou vechi. Pentru a măsura nivelul electrolitului, opriți tuburile bateriilor bateriei și introduceți tubul în plăci. Apoi, din capătul superior, strângeți degetul și ridicați. Nivelul electrolitului din tub trebuie să fie de 10-12 milimetri.
Atenție vă rog! Nu utilizați bateria cu un nivel de electroliți sub partea superioară a plăcilor. Acest lucru reduce foarte mult durata sa de viață.
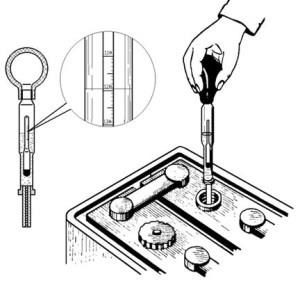
Pentru a măsura densitatea aveți nevoie de un hipermetru. Acest dispozitiv este un tub de sticlă sigilat în care să găsească mercur sau împușcat. La capătul superior al hipermetrului există o scală gradată. Domeniul de măsurare a densității este de 1.100-3.300 g / cm3. Hidrometrul este plasat într-un balon pliabil cu o pere.
Trebuie să coborâți partea inferioară în borcan și să colectați electrolitul. După aceea, scoateți și uitați-vă la valoarea nivelului de electroliți. Hidrometrul însuși va pluti într-un electrolit ca un flotor. La unele modele de hipermetre, o scară cu valori poate fi înlocuită cu inscripțiile "încărcare completă", "jumătate", "descărcare".
Cum de a crește densitatea electrolitului?
Sa spus deja că, ca urmare a hidrolizei apei și a încălzirii bateriei sub capotă, nivelul electrolitului scade treptat, iar densitatea crește. Prin urmare, trebuie să adăugați periodic apă distilată. Și dacă densitatea electrolitului pe o baterie încărcată de mașină, dimpotrivă, este mai mică decât cea normală (1.275 g / cm3)? Apoi trebuie să ridicați concentrația de acid.
Atenție vă rog! Purtați mănuși de cauciuc și ochelari de protecție atunci când lucrați cu acid. Dacă diluați în mod independent electrolitul din acidul concentrat și apa distilată, amintiți-vă că nu puteți turna apă în acid. În acest caz, reacția de hidratare începe cu eliberarea unei cantități mari de căldură. Ca rezultat, apa fierbe și provoacă pulverizare acidă, ceea ce este foarte periculos. Prin urmare, în timpul diluării, este necesar să se toarne acid în apă.
La creșterea densității electrolitului pot exista două opțiuni. Dacă densitatea medie pentru toate băncile nu este mai mică de 1,2 g / cm3, atunci trebuie să creșteți densitatea prin diluare treptată.
Pentru fiecare dintre cutii trebuie să faceți următoarele:
- Împingeți cât mai mult posibil electrolitul din cutie. Pentru a face acest lucru, puteți folosi un bec din cauciuc sau același balon. După aceea, umpleți electrolitul în borcan (densitate 1,275-1,29 gr / cm3) jumătate din volumul pompat;
- Pentru ca electrolitul să se amestece, puteți da o sarcină ieșirilor (de exemplu, conectați un bec de mașină) sau așteptați puțin;
- Apoi măsurați densitatea. Dacă nu se ridică la nivelul dorit, se toarnă electrolitul în jumătate din volumul rămas;
- Se amestecă și se înghesuie din nou;
- Reglați densitatea acidului la nivelul cerut.
Dacă densitatea electrolitului este mai mică de 1,2 g / cm3, atunci este necesar să o modificați complet. Adică scurgeți cel vechi și completați cel nou cu densitatea necesară. Dar, dacă electrolitul are o densitate atât de scăzută în starea încărcată, atunci există îndoieli cu privire la oportunitatea utilizării ulterioare. În acest caz, electrolitul are sens să se schimbe numai dacă bateria este relativ nouă (până la un an). Uneori există baterii auto cu o asemenea densitate de electroliți direct din magazin. Dacă aceasta este deja o baterie care a fost folosită de mai mulți ani, este mai bine să cumpărați o baterie nouă. La eliminarea bateriilor, electrolitul uzat este de asemenea reciclat.
Înapoi la cuprins
Ce am învățat?
Participați la sondaj!
Articole similare
-
Evaluarea bateriei pentru recenzii de la mașini și producători
-
Standarde pentru caracteristicile acidului sulfuric și a electroliților pentru baterii
Trimiteți-le prietenilor: