§ 120. Iron Fe (un subgrup din grupul VIII)
subgrup accesorie din grupa a VIII a tabelului periodic al lui Mendeleev, spre deosebire de celelalte triade cuprinde trei elemente: fier Fe, cobalt Co, nichel familia Ni includ fier, ruteniu Ru, Rh rodiu, paladiu Pd, Os osmiu, iridiu și 1d Platinum Pt este atribuită familiei de metale de platină, bazată pe similitudinea proprietăților lor.
Luați în considerare fierul ca reprezentant al familiei sale în subgrupul secundar al grupului VIII. Fierul se află în a patra perioadă.
Greutatea atomică a fierului este de 55, 84, sarcina nucleului este +26. Distribuția electronilor peste nivelurile de energie (+26): 2, 8, 14, 2. Configurația electronică a stratului exterior și exterior de fier este 3s23p63d64s2.
Astfel, pentru un atom de fier, pe lângă cele două electroni ai celui de-al patrulea strat exterior, există de asemenea șase d-electroni ai celui de-al treilea strat pre-străin. Dintre acești electroni d, cele mai active sunt cele 4 nepereche. În consecință, în formarea legăturilor de valență de fier, 6 electroni sunt implicați cel mai activ - 2 de la exterior și 4 de la straturile existente. Cele mai comune grade de oxidare a fierului sunt Fe + 2 și Fe 3. Fierul este unul dintre elementele cele mai des întâlnite în natură. În prevalența printre elementele rămase, se situează pe locul patru.
■ 57. Pe baza structurii atomului de fier, precum și a distribuției electronilor de-a lungul orbitalilor, se indică posibilele stări de oxidare ale acestui element. (Vezi răspunsul)
Fierul în stare liberă este un metal strălucitor, gri-argintiu, cu o densitate de 7,87, un punct de topire de 1535 ° și un punct de fierbere de 2740 °. Fierul are proprietăți feromagnetice pronunțate, adică sub influența unui câmp magnetic, este magnetizat și, la terminarea acțiunii câmpului, își păstrează proprietățile magnetice, devenind însuși un magnet. Toate elementele grupului de fier posedă astfel de proprietăți.
Conform proprietăților sale chimice, fierul este un metal foarte activ. În absența umidității fierului în aer nu se schimbă, dar atunci când este expusă la umiditate și oxigen este supus la coroziune puternică și rugina acoperite de peliculă în vrac, care este un hidroxid feric, care nu îl protejează de oxidare în continuare, și fierul sunt oxidate încet în toată masa sa:
4Fe + 2H2O + 3O2 = 2Fe2O3 · 2H2O
Au fost dezvoltate mai multe metode de protejare a acestui metal prețios de coroziune.
În seria de solicitări, fierul este situat în stânga hidrogenului. În acest sens, este ușor expus la acizii diluați, transformându-se într-o sare de fier feros, de exemplu:
Fe + 2HCI = FeCl2 + H2 ^
Cu acizii sulfurici și nitrici concentrați, fierul nu reacționează. Acești acizi creează o astfel de peliculă solidă și densă de oxid pe suprafața metalică încât metalul devine complet pasiv și nu mai intră în alte reacții. În același timp, atunci când interacționează direct cu oxidanți puternici ca halogeni. fierul prezintă întotdeauna o stare de oxidare de +3:
2Fe + 3CI2 = 2FeCI3
Fierul reacționează cu aburul supraîncălzit; în timp ce hidrogenul este deplasat din apă. iar fierul roșu fierbinte este transformat într-un oxid și acesta este întotdeauna fie oxid de fier FeO, fie oxid feros Fe3O4 (Fe2O3 · FeO):
Fe + H20 = FeO + H2 ↑
3Fe + 4H2O = Fe3O4 + 4H2 ↑
Fierul fier în oxigen pur arde pentru a forma o scară de fier (vezi Figura 40).
3Fe + 2O2 = Fe3O4
La calcinare, fierul formează un aliaj cu carbon și, în același timp, carbură de fier Fe3C.
■ 58. Listați proprietățile fizice ale fierului.
59. Care sunt proprietățile chimice ale fierului? Dați un răspuns valid. (Vezi răspunsul)
§ 121. Compuși de fier
Fierul formează două serii de compuși - compușii Fe +2 și Fe3. Pentru fier, sunt specifici doi oxizi: oxidul FeO și oxidul de Fe2O3. Adevărat, se cunoaște Fe3O4 de oxid mixt, molecula căruia sunt compușii de oxigen ai fierului bivalent și feric: Fe2O3 · FeO. Acest oxid se numește și scară de fier sau oxid de oxid de fier.
Compuși feroase mai puțin stabil decât oxidul de, și în prezența unui oxidant, chiar dacă numai oxigenul din aer, este de obicei transformat într-un compus de fier trivalent. De exemplu, hidroxid de fier (II) Fe (OH) 2 este un solid de culoare albă, în formă pură, dar ea poate fi obținută numai în cazul soluțiilor de reactanți nu conțin oxigen dizolvat și reacția este condusă în absența oxigenului aer:
FeSO4 + 2NaOH = Fe (OH) 2 + Na2S04
Sarea din care se obține hidroxidul de fier (II), desigur, nu trebuie să conțină cel mai mic amestec de compuși de oxid. Deoarece aceste condiții sunt create în formarea convențională de laborator foarte dificil, hidroxid de fier (II) se obține sub formă de formă mai mult sau mai puțin verde închis precipitat gelatinos, indicând faptul că oxidarea are loc compusi feros la feric. Dacă hidroxidul de fier (II) dețin pentru o lungă perioadă de timp în aer, vine treptat transformarea sa în hidroxid de fier (III) Fe (OH) 3:
4Fe (OH) 2 + 02 + 2H20 = 4Fe (OH) 3
Hidroxizii de fier sunt hidroxizi insolubili tipici. Hidroxidul de fier (II) are proprietăți de bază, în timp ce hidroxidul de Fe (OH) 3 are proprietăți amfoterice foarte slabe exprimate.
■ 60. Listați proprietățile oxidului de fier ca oxid de bază tipic. Dați un răspuns valid. Scrieți toate ecuațiile de reacție în forme ionice complete și scurtate. (Vezi răspunsul)
61. Listați proprietățile hidroxidului de fier (II). Confirmați răspunsul cu ecuațiile de reacție. (Vezi răspunsul)
Printre sărurile de fier (II), sulfat de fier FeSO4 · 7H2O, din care 7 molecule de apă de cristalizare, este de cea mai mare importanță. Vitriolul de fier este ușor solubil în apă. Este folosit pentru combaterea dăunătorilor din agricultură, precum și pentru fabricarea coloranților.
cel mai important este clorura ferică FeCl3, care este o formă de cristale portocalii foarte higroscopice, care absorb apa atunci când este depozitat în pastă brună și neclaritate de sărurile ferice.
Sărurile feroase (II) pot fi ușor transformate în săruri de fier (III), de exemplu, când sunt încălzite cu acid azotic sau cu permanganat de potasiu în prezența acidului sulfuric:
6FeSO4 + 2HNO3 + 3H2S04 = 3Fe2 (SO4) 3 + 2NO + 4H2O
Sărurile Fe + 2 Fe +3 oxidare în sare poate avea loc sub influența oxigenului aerului în timpul depozitării acestor compuși, dar acest proces este mai lung. Pentru recunoașterea cationilor de Fe2 + și Fe3 +, servesc reactivi specifici foarte specifici. De exemplu, pentru detectarea feros iau sare Blutwurst roșu K3 [Fe (CN) 6], care, în prezența ionilor feroase oferindu-le caracteristic precipitat turnbulevoy albastru intens albastru:
3FeS04 + 2K3 [Fe (CN) 6] = Fe3 [Fe (CN) 6] 2 + 3K2S04
sau sub formă ionică
3Fe 2+ + 2 [Fe (CN) 6] 3 = Fe3 [Fe (CN) 6] 2
Pentru a recunoaște sărurile de Fe3 +, se utilizează o reacție cu sarea de sânge galben K4 [Fe (CN) 6]:
4FeCl3 + 3K4 [Fe (CN) 6] = Fe4 [Fe (CN) 6] 3 + 12 KCI
4Fe 3+ + 3 [Fe (CN) 6] 4 = Fe4 [Fe (CN) 6] 3
În același timp, în azurul din Berlin precipită o intensă culoare albastră. Albastru de azur și albastru de turnbull sunt utilizate ca coloranți.
În plus, fierul feric poate fi recunoscut cu ajutorul sărurilor solubile - tiocianat de potasiu KCNS sau tiocianat de amoniu NH4CNS. Când aceste substanțe interacționează cu sărurile de Fe (III), soluția are o culoare roșie sanguină.
62. Listați proprietățile sărurilor Fe +3 și Fe +2. Ce grad de oxidare este mai stabil?
63. Cum se convertește sarea Fe +2 într-o sare de Fe +3 și invers? Dați exemple. (Vezi răspunsul)
Reacția se desfășoară conform ecuației:
FeCI3 + 3KCNS = Fe (CNS) 3 + 3KS1
sau sub formă ionică
Fe 3+ + 3CNS - = Fe (CNS),
Compușii de fier joacă un rol important în viața organismelor. De exemplu, face parte din proteina principală a sângelui - hemoglobina, precum și materia verde a plantelor - clorofila. Fier intră în organism în principal în substanțele organice ale alimentelor. O mulțime de fier conține mere, ouă, spanac, sfecla. Ca medicamente, fierul este utilizat sub formă de săruri de acizi organici. Clorura ferică servește ca agent hemostatic.
64. Trei tuburi conțin: a) sulfat de fier (II); b) sulfat de fier (III) și c) clorură de fier (III). Cum să determinați ce eprubetă conține ce sare?
65. Cum se face un număr de transformări:
Fe → FeCl2 → FeSO4 → Fe2 (SO4) 3 → Fe (OH) 3 → Fe2O3.
66. Sunt indicate următoarele substanțe. fier, acid clorhidric. clor. caustic sifon. Cum, folosind doar aceste substanțe, se obține hidroxid de fier (II) și hidroxid feric (III)?
67. O soluție conținând clorură de crom (III) și clorură de fier (III) a fost tratată cu un exces de alcaline. Precipitatul rezultat a fost filtrat. Ce a mai rămas pe filtru și ce a trecut în filtrat? Dați un răspuns valid utilizând ecuațiile de reacție în formele ionice moleculare, ionice totale și reduse. (Vezi răspunsul)
§ 122. Aliaje de fier
Fierul este baza metalurgiei feroase, deci este extras în cantități imense. Noul program de construcție cuprinzătoare a comunismului prevede producerea a 250 de milioane de tone de oțel în 1980. Acesta este de 3,8 ori mai mare decât în 1960.
Fierul este aproape niciodată folosit în formă pură, dar numai sub formă de aliaje. Cele mai importante aliaje ale fierului sunt aliajele sale cu carbon - diverse fontă și oțel. Principala diferență de fontă din oțel în conținutul de carbon: din fontă conține mai mult de 1,7% carbon, iar în oțel - mai puțin de 1,7%.
De mare importanță practică sunt feroaliajele (aliaj de fier-siliciu), ferocrom (aliaj de fier-crom), feromangan (aliaj de fier-mangan). Feroaliajele sunt fontă care conține mai mult de 10% fier și nu mai puțin de 10% din componenta corespunzătoare. În plus, ele au aceleași elemente ca în fontă. Feroaliajele sunt utilizate în principal pentru "deoxidarea" oțelului și ca impurități de aliere.
Printre fonta, se disting liniar și redundant. Fonta este utilizată pentru turnarea diferitelor piese, re-turnarea fierului este remodelată în oțel, deoarece are duritate foarte mare și nu poate fi procesată. Fonta este albă, iar fonta este gri. Fierul de fier conține mai mult mangan.
Otelul poate fi carbon si aliaj. Oțelul carbon este, de obicei, un aliaj de fier cu carbon, iar aliajele conțin aditivi de aliere, adică impurități ale altor metale, dând oțelului proprietăți mai valoroase. Vanadiul dă ductilitatea, elasticitatea, rezistența la călire, tungsten și molibden - duritatea și rezistența la căldură. Oțelul cu aditivi de zirconiu este foarte elastic și plastic; ele sunt utilizate pentru fabricarea plăcilor blindate. Impuritățile de mangan fac oțelul rezistent la șocuri și frecare. Borul mărește proprietățile de tăiere ale oțelului în fabricarea oțelurilor pentru scule.
Uneori, chiar și impuritățile minore ale metalelor rare dau proprietăți noi oțelului. Dacă componenta de oțel dintr-o pulbere de beriliu este menținută la o temperatură de 900-1000 °, atunci duritatea oțelului, rezistența la uzură este foarte mare.
Cromul-nichel sau, așa cum se mai numește și inoxidabil, oțelul este rezistent la coroziune. Impuritățile de sulf și fosfor lezează grav oțelul - fac ca metalul să fie fragil.
68. Care sunt cele mai importante aliaje de fier pe care le cunoști? (Vezi răspunsul)
69. Care este principala diferență față de fontă?
70. Care sunt proprietățile fontei și ce tipuri de fontă știți?
71. Ce sunt oțelurile aliate și aditivii de aliere? (Vezi răspunsul)
§ 123. Procesul de domeniu
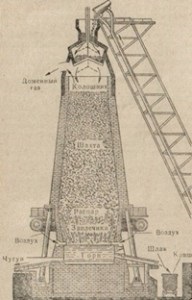
Fig. 83. Diagramă a dispozitivului cuptorului.
cade în arborele lung al cuptorului, care se extinde dinspre partea inferioară, ceea ce facilitează mișcarea materialului de alimentare de sus în jos. Deoarece mișcarea taxei pentru cea mai mare parte a cuptorului - aburit - ea trece printr-o serie de transformări, în urma căruia o distributie, care curge în cuptor - cea mai tare parte a cuptorului. Slag este, de asemenea, colectat aici. Fonta și zgura sunt evacuate din cuptor prin deschideri speciale în cuptor, numite călcare. Prin partea superioară a cuptorului, aerul este suflat în cuptorul de furnal, care susține arderea combustibilului în cuptor.
Să luăm în considerare procesele chimice care apar în timpul topirii fontei. Încărcarea unui cuptor, adică a unui complex de substanțe încărcate în el, constă din minereu de fier, combustibil și flux, sau fluide. Există multe minereuri de fier. Minerele principale sunt minereul de fier magnetic Fe3O4, minereul de fier de Fe2O3 roșu, minereul de fier 2Fe2O8 · 3H2O. În procesul de furnal în minereu de fier este folosit ca FeCO3 siderit și uneori pirită FeS2, strunjire după cuptoarele de calcinare zgură piritei în Fe2O3, care pot fi utilizate în metalurgie. Acest minereu este mai puțin de dorit din cauza amestecului mare de sulf. Topirea în furnal este nu numai fontă, ci și feroaliaje. Combustibil încărcat în cuptor, servește simultan pentru a menține o temperatură ridicată într-un cuptor de reducere a fierului din minereu, și, de asemenea, participă la formarea unui aliaj de carbon. Combustibilul este de obicei cocs.
În procesul de topire a fontei, cocsul este gazificat, dezvoltându-se, ca într-un generator de gaz, mai întâi în dioxid și apoi în monoxid de carbon:
C + O2 = CO3C02 + C = 2CO
Monoxidul de carbon rezultat este un agent de reducere a gazelor bun. Cu ajutorul său, minereul de fier este recuperat:
Fe2O3 + 3CO = 3CO2 + 2Fe
Împreună cu minereul care conține fier, impuritățile de gangă trebuie să intre în mod necesar în cuptor. Ele sunt foarte refractare și pot bloca cuptorul, care a funcționat continuu de mai mulți ani. Pentru ca roca să fie ușor extrasă din cuptor, ea este transformată într-un compus cu punct de topire scăzut, transformându-se în fluxuri (fluxuri) în zgură. Pentru transferul în zgura pietrei principale, care conține, de exemplu, calcar, care se descompune în cuptor conform ecuației
CaCO3 = CaO + CO2
adăugați nisipul. Fuzionarea cu oxid de calciu, nisipurile formează silicat:
CaO + SiO3 = CaSi03
Este o substanță cu un punct de topire incomparabil mai mic. În stare lichidă, poate fi descărcată din cuptor.
În cazul în care speciile acide care conțin o cantitate mare de dioxid de siliciu, apoi încărcat în cuptor, în mod contrar, calcar, care se traduce silicat de dioxid de siliciu, iar rezultatul este aceeași zgură. Anterior, zgura era o risipă, iar acum este răcită cu apă și folosită ca material de construcție.
Pentru a menține arderea combustibilului în furnal, aerul încălzit, îmbogățit cu oxigen este alimentat în mod continuu. Se încălzește în încălzitoare speciale de aer - kyuperah. Cowper - un turn înalt, construit din cărămizi refractare, care sunt deviate de la gazele fierbinți de furnal. Gazele de domeniu conțin dioxid de carbon CO2, azot N2 și monoxid de carbon CO. Monoxidul de carbon arde în Cowper, crescând astfel temperatura acestuia. Apoi, gazele de furnal sunt trimise automat la un alt cauper, iar prin primul, aerul este suflat, trimis la cuptor. În cazatorul fierbinte, aerul este încălzit și, prin urmare, este economisit combustibil, care în cantități mari ar fi cheltuit pentru încălzirea aerului care intră în furnal. Fiecare cuptor are mai mulți coppers.
■ 72. Care este compoziția încărcăturii cuptorului? (Vezi răspunsul)
73. Listați principalele procese chimice care apar în timpul topirii fontei.
74. Care este compoziția gazului de furnal și cum este folosit în Cowperers?
75. Câte fier fonic conținând 4% carbon poate fi obținut de la 519, 1 kg de minereu de fier care conține 10% impurități?
76. Cât de mult cocs produce un volum de monoxid de carbon suficient pentru a reduce 320 kg de oxid de fier, dacă cocsul conține 97% pur carbon?
77. Cum să se ocupe de siderit și de pirită. ca să poți obține fier de la ei? (Vezi răspunsul)
§ 124. Topirea oțelului
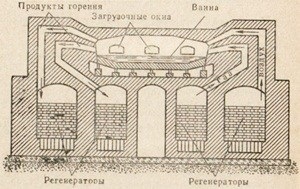
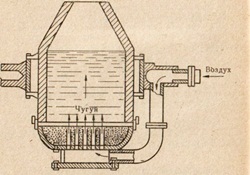
Fig. 85. Diagrama convertorului de dispozitiv Bessemer
În cuptoarele electrice (Figura 86), oțelul aliat de calități speciale este topit, în principal cu un punct de topire ridicat care conține cobalt. crom. tungsten și alți aditivi. Oțelul finit este trimis la rulare. Există un imens împotriva mori de rulare - înflorite mori și brame - sertizate lingouri din otel cald folosind role, permițând fabricarea benzii de oțel o varietate de forme.
Fierul sub formă de aliaje este utilizat pe scară largă în economia națională. Fără ea, nu o ramură a economiei naționale. Pentru a salva metalele feroase, ei încearcă acum să le înlocuiască cu materiale sintetice în măsura posibilului.
Din fier sau din oțel produce mașini și mașini, avioane și instrumente, supape pentru construcții din beton, cutii de tabla de conserve și foi de acoperiș din metal, nave și poduri, mașini și grinzi agricole. țevi și o serie de produse de uz casnic.
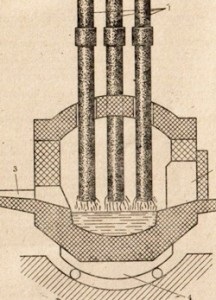
Figura 86. Diagrama unui cuptor cu arc electric.
1-electrozi, 2-ferestre de încărcare, 3 canale pentru producția de oțel, 4-pivot mecanism
Știi cum
Trimiteți-le prietenilor: