Începem să comprimăm gazul, menținând temperatura constantă, de la un punct A. Ramura izotermei AB (în ambele figuri) corespunde compresiei gazului la presiuni reduse. Proprietățile gazului din secțiunea AB sunt foarte apropiate de cele ale unui gaz ideal. Când se atinge o anumită presiune P0, comportamentul gazului se schimbă brusc.
Gazul continuă să fie comprimat, volumul acestuia scade, iar presiunea rămâne aceeași (Figura 16.3), egală cu P0. Secțiunea WS a izotermei experimentale corespunde procesului de lichefiere a gazului, adică În secțiunea gazului, gazul se transformă într-un lichid (BC este linia de condensare a aburului). În această regiune, substanța există simultan în două faze: lichidul este o fază, iar a doua fază este gazul, care în acest caz este vapori saturați în raport cu lichidul. Presiunea vaporilor saturați depinde numai de temperatură, dar nu depinde de volum. Prin urmare, presiunea P0 nu se modifică până când toată vaporii la o anumită temperatură nu au trecut în lichid. Presiunea P0 este numită presiunea de vapori la o temperatură dată T. La punctul B, toată substanța era încă în stare gazoasă, la punctul C toată substanța este deja în stare lichidă.
Ramura izotermei SD (pe ambele izoterme) caracterizează procesul de compresie a fluidului. Lichidele au o compresibilitate scăzută, astfel încât curba SD crește abrupt.
Secțiunea izotermei teoretice Van der Waals VE poate fi obținută experimental. Secțiunea este caracterizată de vapori saturați. și anume perechi a căror densitate este mai mare decât densitatea vaporilor saturați la o temperatură dată. Starea vaporilor suprasaturați este o stare de stabilitate scăzută. Vaporii sunt ușor condensați, trec parțial într-un lichid, iar vaporii rămași sunt apoi aburi saturați.
Secțiunea izotermelor teoretice de la Van der Waals poate fi obținută și experimental. Caracterizează starea instabilă a lichidului întins. și anume lichid cu o densitate mai mică decât ar trebui să aibă la o anumită temperatură. Un astfel de lichid se obține dacă este curățat cu atenție de orice impurități.
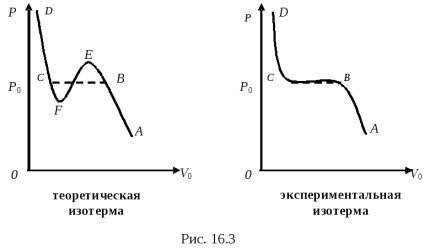
Este imposibil să obținem experimental secțiunea izotermei teoretice a lui Van der Waals.
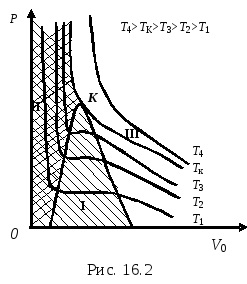
Fiecare izotermă experimentală corespunde unei temperaturi T = const. Cu temperaturi în creștere, secțiunile rectiliniare ale izotermelor corespunzătoare devin deja la o anumită temperatură Tc a punctelor B și C. delimitând o secțiune rectilinie, se îmbină într-un punct K. Izoterma pe care linia de condensare este reprezentată ca punct este o izotermă critică. Temperatura corespunzătoare izotermei critice este temperatura critică Tc. Izotermă corespunzătoare temperaturii critice Tc. are doar punctul de inflexiune. Tangenta la punctul K este paralela cu axa abscisa. Izotermele la temperaturi peste Tc nu au nici maxime, nici minime, nici secțiuni drepte și sunt aproape de izotermele unui gaz ideal.
Un punct K este numit punct critic. temperaturile corespunzătoare se numesc temperatura critică, presiunea și respectiv volumul. Temperatură critică Temperatura la care dispare diferența dintre starea lichidă și cea gazoasă a substanței. Temperatura critică Tc este diferită pentru diferite substanțe. Starea materiei la o temperatură critică se numește starea critică a materiei. În această stare, substanța dobândește proprietăți speciale, de exemplu, forțele de adeziune dintre molecule dispar, substanța nu are o tensiune superficială și așa mai departe.
La temperaturi sub critică, substanța poate exista în funcție de presiune, fie în stare lichidă sau gazoasă, fie într-o stare în două faze (lichid și vaporii simultan).
La temperaturi peste temperatura critică, substanța poate exista numai în stare gazoasă și nu poate fi transformată într-o stare lichidă prin nici o comprimare. Gazul trebuie să fie mai întâi răcit în TTCK. și numai apoi comprima.
Starea critică a substanței corespunde punctului unic al izotermei critice, punctul în care linia de condensare sa transformat. Acest punct este numit critic. Parametrii substanței în punctul critic sunt numiți parametri critici. Pentru a le determina este necesar să se stabilească poziția punctului critic pe planul de coordonate P, V.
Orice izotermă van der Waals, inclusiv izotermul critic, este descris de Eq.
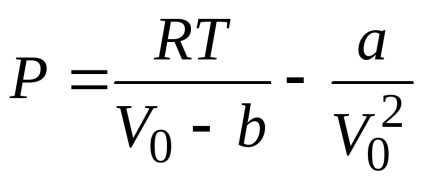
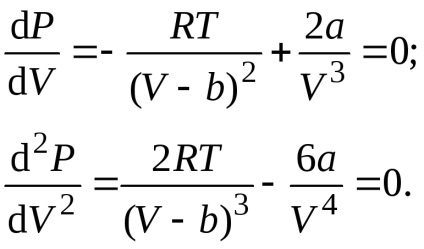
Rezolvând ecuațiile împreună, găsim valorile parametrilor critici:
unde a, b sunt constante din ecuația van der Waals care descrie starea unui anumit gaz real, R este constanta gazului universal. În figură, regiunea I (umbrită) este regiunea stării bi-fază a materiei, regiunea II (ecloza dublă) este regiunea stării lichide, regiunea III (nu este umbrită) este regiunea stării gazoase.
Articole similare
Trimiteți-le prietenilor: